1. Одним з основних завдань селекціонерів завжди було отримання високоврожайних сортів рослин з підвищеною харчовою цінністю. Найбільша увага приділялася при цьому таким зерновим культурам як кукурудза, пшениця і рис, проте були здійснені програми і по схрещуванню інших сільськогосподарських і садових культур. В якості важливого інструменту прямого генетичного впливу на рослини застосовується технологія рекомбінантних днк, широко використовується в мікробіологічних системах. До теперішнього часу розроблено кілька ефективних систем перенесення днк і експресують векторів , які працюють в ряді рослинних клітин. Одним з достоїнств останніх є їх тотипотентність: з однієї клітини може бути регенеровано ціле рослина, так що з клітин, сконструйованих генноінженерних методами, можна отримати фертильні рослини, всі клітини яких несуть чужорідний ген (трансгенні рослини). Якщо така рослина цвіте і дає життєздатні насіння, то бажаний ознака передається наступним поколінням.
Можна навести три основні аргументи на користь отримання трансгенних рослин. По-перше, введення гена (генів) часто призводить до підвищення сільськогосподарської цінності та декоративних якостей культурних рослин. По-друге, трансгенні рослини можуть служити живими біореакторами при маловитратному виробництві економічно важливих білків або метаболітів. По-третє, генетична трансформація рослин (трансгеноз) дозволяє вивчати дію генів в ході розвитку рослини та інших біологічних процесів.
На сьогоднішній день вже отримані численні трансгенні рослини на основі як культурних, так і диких видів, які придбали такі цінні ознаки як інсектицидна активність, стійкість до вірусних захворювань і гербіцидів, уповільнення старіння, стійкість до несприятливих умов навколишнього середовища, змінене забарвлення квіток, підвищена харчова цінність насіння. Генна інженерія внесла корективи в традиційні програми розведення рослин, в рамках яких для виведення нового сорту потрібно від 10 до 15 років.
Один з головних методичних прийомів генної інженерії рослин заснований на використанні ti-плазміди з agrobacterium tumefaciens . Ця грамнегативна грунтова бактерія-фітопатоген, який в процесі свого життєвого циклу трансформує клітини рослин. Трансформація призводить до утворення корончатого галла — пухлини, що порушує нормальний ріст рослини (рисунок 1). Цій хворобі, що має серйозні агрономічні наслідки, схильні тільки дводольні рослини, зокрема виноград, кісточкові фруктові дерева, троянди.
Рисунок 1 — інфікування рослин агробактеріями
Утворення корончатого галла починається з проникнення, вбудовування в геном рослинних клітин і експресії специфічного фрагмента бактеріальної плазмідної днк-так званої т-днк (від англ. Transferred dna), довжина якої становить 12-22 тис.пар основ. Т-днк-це частина плазміди, що індукує розвиток пухлини (tumor inducing plasmid, ti –плазміди); її несуть більшість штамів a. Tumefaciens .
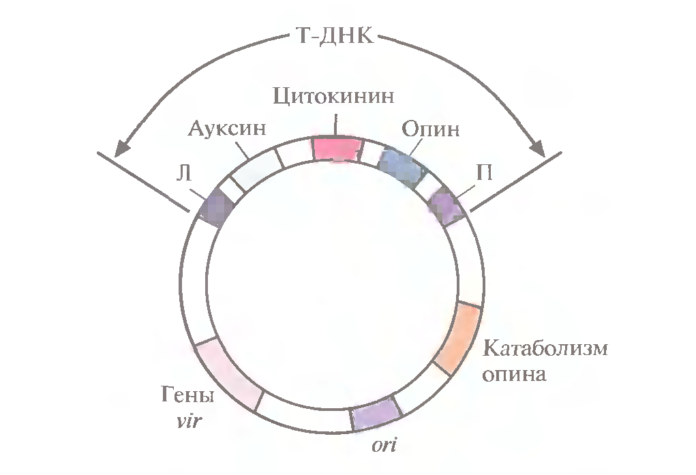
Т-днк містить гени пухлиноутворення , вони кодують ферменти синтезу фітогормонів , що викликають збільшення розмірів рослинних клітин (ауксин ) і їх нестримну проліферацію (цитокінін ). Крім того , інфіковані рослинні клітини починають синтезувати специфічну амінокислоту опін, який може використовуватися тільки бактеріями a. Tumefaciens .
Інфекційний процес починається з прикріплення a. Tumefaciens до клітин рослини в місці пошкодження, часто біля основи стебла (у кореневої шийки). Раніше передбачалося, що a. Tumefaciens заражає саме пошкоджені рослини внаслідок руйнування клітинної стінки і усунення фізичного бар’єру, що утрудняє проникнення бактерій в клітину. Однак зараз вважається, що вся справа в специфічних фенольних сполуках, ацетосірінгоні і гідроксіацетосірінгоні, які виділяє пошкоджене рослина; вони активують кластер генів вірулентності (vir), які локалізовані в ділянці ti — плазміди довжиною 35 т.п. Н., що знаходиться за межами т-днк. Продукти vir-генів необхідні для транспорту і вбудовування т-днк в геном рослинної клітини. Поруч знаходяться гени утилізації опінів, а також локуси, що контролюють реплікацію плазміди в бактеріальній клітині і її перенесення при бактеріальній кон’югації (рис. 2).
Один з п’яти генів вірулентності vird кодує ендонуклеазу . Область т-днк оточена однаковими повторами довжиною 25 пар основ. Ці послідовності є сайтами впізнавання vird-ендонуклеази, ріжучої точно між 3-м і 4-м підставами 25 пар підстав повтору. Ця ендонуклеаза відповідальна за вирізання т-днк. Вбудовування її відбувається за механізмом гомологічної рекомбінації; є гомологія між рослинною днк по обидва боки від місця вбудовування і зовнішніми областями плазмідної днк.
В геном рослини можуть вбудовуватися кілька копій т-днк. Після вбудовування в хромосому т-днк стає звичайною частиною геному росту, відбувається її транскрипція рнк — полімеразою рослини — господаря, а потім – трансляція. Сама бактерія в клітину не проникає , а залишається в міжклітинному просторі і використовує рослинні клітини з вбудованою т-днк як фабрику, що продукує для неї опіни — джерело азоту і вуглецю.
Щоб використовувати природну здатність a . Tumefaciens проникати в рослинні клітини для доставки в них клонованих генів, були створені вектори на основі ti-плазміди.
Малюнок 2-генетична карта ti-плазміди. Т-днк містить гени ауксину, цитокініну і опіну, які транскрибуються тільки в рослинних клітинах. За межами т-днк знаходяться vir-гени, гени ферментів катаболізму опіна і сайт початку реплікації. Л і п — ліва і права фланкуючі послідовності
Всі вектори на основі т i-плазмід мають наступні елементи :
Селективний маркерний ген, наприклад ген неоміцинфосфотрансферази, який забезпечує стійкість трансформованих рослинних клітин до канаміцину. Оскільки цей ген (як і багато інших маркерних генів, що використовуються при трансформації рослин) за своєю природою прокаріотичний, необхідно поставити його під контроль рослинних (еукаріотичних) сигналів регуляції транскрипції, в тому числі промотора і сигналу термінації-поліаденілірованія. Це забезпечує ефективну експресію гена в трансформованих рослинних клітинах;
Сайт ініціації реплікації (ori), який дозволяє плазміді реплікуватися в е .со li. Деякі вектори містять також і сайт ініціації реплікації в a . Tumefaciens ;
Права фланкуюча послідовність т-днк. Цей елемент абсолютно необхідний для інтеграції т-днк в клітинну днк рослин. Більшість же векторів містять як праву, так і ліву фланкуючі послідовності;
— полілінкер (множинний сайт клонування) для вбудовування гена в ділянку між кордонами т-днк;
Оскільки клонуючі вектори не містять генів vir, вони самі не здатні забезпечувати доставку і інтеграцію т-днк в клітини рослини-господаря. Щоб вирішити цю проблему, було розроблено два підходи. У першому випадку використовують бінарну векторну систему.
Бінарний клонуючий вектор містить сайти ініціації реплікації і для е .со li , і для a. Tumefaciens, але не несе генів vir, тобто це практично човниковий вектор е .со li — a. Tumefaciens . Всі стадії клонування проводять в е. Со li, а потім вектор вводять в a . Tumefaciens . Штам-реципієнт a. Tumefaciens несе модифіковану неонкогенну (»роззброєну») ті-плазміду; вона містить повний набір vir-генів, але з неї видалена частина (або вся) т-днк (так що т-днк не може бути транспортована). Продукуючи білки, що кодуються vir-генами, неонкогенна ті-плазміда виступає в ролі помічника , сприяючи вбудовуванню т-днк з бінарного клонуючого вектора в хромосомну днк рослини.
У другому випадку використовують коінтегративну векторну систему. Векторна днк рекомбінує в а . Tumefaciens з «роззброєною» ті-плазмідою, т-днк якої не несе пухлинних генів, таким чином, що весь клонуючий вектор вбудовується в неонкогенну ті-плазміду.
При конструюванні векторних молекул має бути передбачено наявність промоторів , що працюють в рослинах. Промотор (ділянка, до якої приєднуються рнк-полімерази) повинен володіти набором властивостей, а саме: силою (активною експресією), можливістю регуляції, ткане — і органспецифической експресією. Так, наприклад, до регульованих промоторів відноситься промотор генів білків теплового шоку (генів, активність яких індукується приПідвищеній температурі), а тканеспецифічна експресія характерна для генів, контролюючих синтез запасних білків, наприклад зеїну , який виявлений тільки в тканинах насіння злаків. Найбільш популярним є промотор гена вірусу мозаїки цвітної капусти (camv). Гени, підшиті до такого промотору, активно експресуються у всіх тканинах.
Нарешті, у векторі повинні бути передбачені маркери, за допомогою яких можливий відбір трансгенних рослин. У літературі маркерні гени ще називають репортерними . Їх досить багато. Наприклад, luxa і luxb — це гени, виділені з днк світлячків. Вони контролюють синтез люциферази, яка забезпечує перехід люцеферинів з окисленої форми в основну, що і забезпечує світіння. Останнім часом користується популярністю інший репортерний ген-ген зеленого флуоресціюючого білка gfp (green fluorescent protein). Цей ген був виділений з днк медузи acquorea victoria . Трансгенні рослини з цим геном світяться в ультрафіолеті зеленим світлом.
Традиційний спосіб трансформації рослинних клітин за допомогою т-днк полягає в нанесенні агробактерій, що містять ti-плазміду, на спеціально пошкоджений втечу. На жаль, ця система доставки застосовна не для всіх видів рослин. Ефективним методом доставки днк в різні рослинні клітини є також бомбардування мікрочастинками золота або вольфраму з днк, нанесеної на їх поверхню (біобалістика , або біолістика ). Створено навіть спеціальний дробовик — «shotgun», який стріляє цими кульками.
Були також розроблені методи вбудовування чужорідних генів безпосередньо в хлоропластну або мітохондріальну днк так, щоб кодований білок синтезувався прямо в цих органелах. І нарешті, для того щоб заспокоїти громадськість, були розроблені методи видалення маркерних генів з трансгенних рослин.
Федеральне агентство з освіти
Федеральна державна установа
Вищої професійної освіти
«сибірська академія державної служби»
Кафедра регіональної економіки
Контрольна робота
Генетична інженерія: плюси і мінуси
Виконав:
Студент 1 курсу гр.08116
Задворнова а. В.
Старший викладач
Гаврилова н. Г.
У 1972 році з’явилася перша публікація, в якій повідомлялося про отримання in vitro рекомбінантної днк, що складається з фрагментів різних молекул днк: вірусної, бактеріальної та фагової. Робота була виконана американським вченим полом бергом з співробітниками і ознаменувала народження нової галузі молекулярної біології — генетичної (генної) інженерії.
З тих пір почався бурхливий розвиток цієї науки. Однак після перших успішних експериментів з рекомбінацією молекул днк в пробірці з’явилися перші сумніви і побоювання, чи не принесе генна інженерія шкоди природі і людству. У липні 1974 року кілька великих вчених звернулися до наукової громадськості з пропозицією накласти мораторій на роботи з рекомбінантними днк in vitro. У лютому 1975 року в каліфорнії на асіломарской конференції зібралися 140 вчених різних країн, що працюють в області генної інженерії. Всебічно вивчивши результати і можливі наслідки, вчені прийшли до висновку, що потенційні небезпеки невеликі, так як рекомбінантні штами в природних умовах нежиттєздатні і їх безконтрольне поширення малоймовірно. Було вирішено перервати мораторій і продовжити дослідження з дотриманням спеціально розроблених правил. Сьогодні ми можемо відзначити, що майже за чверть століття свого існування генна інженерія не заподіяла ніякої шкоди самим дослідникам, не принесла шкоди ні природі, ні людині. Звершення генної інженерії як в пізнанні механізмів функціонування організмів, так і в прикладному плані досить значні, а перспективи воістину фантастичні. Цими фактами обумовлюється актуальність проблеми.
Мета роботи-вивчивши матеріал про генетичну інженерію, сформулювати її плюси і мінуси
Завдання роботи:
1. Вивчити літературу по темі
2. Виділити напрямки генетичної інженерії
3. Проаналізувати матеріал для формулювання «плюсів» і «мінусів» науки.
Генетична інженерія-напрямок досліджень в молекулярній біології і генетиці, кінцевою метою яких є отримання за допомогою лабораторних прийомів організмів з новими, в тому числі не зустрічаються в природі, комбінаціями спадкових властивостей.
В основі генної інженерії лежать досягнення молекулярної біології і перш за все встановлення універсальності генетичного коду (у всіх організмів включення одних і тих же амінокислот в будується поліпептидний ланцюг білка кодується одними і тими ж послідовностями трьох нуклеотидів в ланцюзі днк). Методом генної інженерії отримано вже ряд препаратів, в тому числі інсулін людини і противірусний препарат інтерферон. І хоча ця технологія ще тільки розробляється, вона обіцяє досягнення величезних успіхів і в медицині, і в сільському господарстві. У медицині, наприклад, це дуже перспективний шлях створення і виробництва вакцин. Таким шляхом отримані продуценти ряду антибіотиків, амінокислот, вітамінів, у багато разів більш ефективні, ніж їх продуценти, виведені традиційними методами генетики і селекції. У сільському господарстві за допомогою рекомбінантної днк можуть бути отримані сорти культурних рослин, стійкі до посухи, холоду, хвороб, комах-шкідників і гербіцидів. З практичних досягнень г.і. Найбільш важливими є створення продуцентів біологічно активних білків — інсуліну, інтерферону, гормону росту та ін., а також розробка способів активізації ланок обміну речовин, які пов’язані з утворенням низькомолекулярних біологічно активних сполук. Таким шляхом отримані продуценти ряду антибіотиків, амінокислот, вітамінів, у багато разів більш ефективні, ніж їх продуценти, виведені традиційними методами генетики і селекції. Г і. Розробляються способи отримання чисто білкових вакцин проти вірусів гепатиту, грипу, герпесу, ящуру, реалізована ідея використання для вакцинації комбінованого вірусу вісповакцини, в геном якого вбудовані гени, що кодують синтез білків інших вірусів (наприклад, вірусів гепатиту або грипу). В результаті щеплення таким вірусом організм отримує можливість виробити імунітет не тільки проти віспи, але і проти гепатиту, грипу або іншого захворювання, що викликається тим вірусом, синтез білка якого котирується вбудованим геном.
Можна виділити три напрямки генної інженерії:
1. Генетична трансформація клітин бактерій
2. Введення генів у клітини ссавців
3. Генна інженерія рослин
Більш детально зупинимося на пунктах 2 і 3.
Лікування захворювань за допомогою генів отримало назву генотерапії. Зараз у світі налічується близько 400 проектів, присвячених лікуванню за допомогою генотеропії.
Величезні перспективи відкриває використання генотерапії для лікування онкологічних захворювань. Багаторічні зусилля вчених привели до розуміння того, що рак — це генетичне захворювання і його розвиток відбувається багатостадійно, в результаті серії генетичних порушень, що накопичуються в клітині. Отже, кожен з таких окремих генетичних ефектів може стати точкою прикладання генотерапевтичного підходу.
Отримання трансгенних тварин
Якщо вводити днк в клітини багатоклітинного організму, то результатом трансформації буде зміна властивостей лише невеликого числа клітин, які придбали новий ген або гени. Отже, для зміни властивостей всього організму слід змінювати геном статевих клітин, які перенесуть нові властивості нащадкам. У рослин і тварин доцільно змінювати такі властивості, як швидкість росту, стійкість до захворювань, здатність адаптуватися до нових зовнішніх умов. В якості маркерів в цьому випадку можна використовувати поліморфізм довжини рестрикційних фрагментів( aflp), аналіз міні-сателітів, аналіз мікросателітної днк (ssr), гібридизацію і т.д. Трансгенних тварин можна використовувати для вивчення спадкових захворювань мозку і нервової системи. Гени хвороби альцгеймера (відкладення білка β-амілоїду призводить до утворення характерних бляшок) і гени, що відповідають за розвиток епілепсії, хвороб мозку вводяться в геном нормальних тварин; при цьому отримують трансгенних тварин-моделей, на яких можна відчувати різні терапевтичні прийоми.
Трансгенних тварин стали використовувати для дослідження запальних та імунологічних захворювань людини, наприклад, ревматоїдного артриту. Моделюються хвороби, пов’язані з ліпідним обміном.
Генетична інженерія рослин, що належить до так званих високих технологій, викликаєНайбільша кількість суперечок і дискусій серед різних кіл громадськості.
Розвиток генетичної інженерії рослин дуже актуально в даний час у зв’язку з тим, що число населення світу зростає, а кількість орних земель зменшується. За допомогою генної інженерії можна підвищити поживну цінність харчових продуктів, підвищити стійкість рослин до зовнішніх умов і багато іншого. Крім виробництва продуктів харчування великими областями застосування генетично модифікованих рослин є створення лікарських засобів, забезпечення промисловості сировиною та інше.
В даний час отриманням і випробуванням генетично модифікованих рослин займаються сотні комерційних фірм у всьому світі з сукупним капіталом понад сто мільярдів доларів. У 1999 р трансгенні рослини були висаджені на загальній площі близько 40 млн. Га, що перевищує розміри такої країни, як великобританія. У сша генетично модифіковані рослини (gm crops) складають зараз близько 50% посівів кукурудзи та сої і більше 30-40% посівів бавовнику. Це говорить про те, що генно-інженерна біотехнологія рослин вже стала важливою галуззю виробництва продовольства та інших корисних продуктів, що залучає значні людські ресурси і фінансові потоки. У найближчі роки очікується подальше швидке збільшення площ, зайнятих трансгенними формами культурних рослин.
Перша хвиля трансгенних рослин, допущених для практичного застосування, містила додаткові гени стійкості (до хвороб, гербіцидів, шкідників, псування при зберіганні, стресів).
Нинішній етап розвитку генетичної інженерії рослин отримав назву «метаболічна інженерія». При цьому ставиться завдання не стільки поліпшити ті чи інші наявні якості рослини, як при традиційній селекції, скільки навчити рослину виробляти абсолютно нові сполуки, використовувані в медицині, хімічному виробництві та інших областях. Цими сполуками можуть бути, наприклад, особливі жирні кислоти, корисні білки з високим вмістом незамінних амінокислот, модифіковані полісахариди, їстівні вакцини, антитіла, інтерферони та інші «лікарські» білки, нові полімери, що не засмічують навколишнє середовище і багато, багато іншого. Використання трансгенних рослин дозволяє налагодити масштабне і дешеве виробництво таких речовин і тим самим зробити їх більш доступними для широкого споживання.
До кінця 1980-х вдалося успішно впровадити нові гени в десятки видів рослин і тварин — створити рослини тютюну зі світяться листям, томати, легко переносять заморозки, кукурудзу, стійку до впливу пестицидів.
Одне з важливих завдань — отримання рослин, стійких до вірусів, так як в даний час не існує інших способів боротьби з вірусними інфекціями сільськогосподарських культур. Введення в рослинні клітини генів білка оболонки вірусу, робить рослини стійкими до даного вірусу. В даний час отримані трансгенні рослини, здатні протистояти впливу більше десятка різних вірусних інфекцій.
Ще одне завдання пов’язане із захистом рослин від комах-шкідників. Застосування інсектицидів не цілком ефективно, по-перше, через їх токсичності, по-друге, тому, що дощовою водою вони змиваються з рослин. У генно-інженерних лабораторіях бельгії та сша були успішно проведені роботи по впровадженню в рослинну клітину генів земляної бактерії bacillus thuringiensis, що дозволяють синтезувати інсектициди бактеріального походження. Ці гени ввели в клітини картоплі, томатів і бавовнику. Трансгенні рослини картоплі і томатів стали стійкі до непереможного колорадського жука, рослини бавовнику виявилися стійкими до різних комах, в тому числі до бавовняної совку. Використання генної інженерії дозволило скоротити застосування інсектицидів на 40-60%.
Генні інженери вивели трансгенні рослини з подовженим терміном дозрівання плодів. Такі помідори, наприклад, можна знімати з куща червоними, не боячись, що вони перезріють при транспортуванні.
Список рослин, до яких успішно застосовані методи генної інженерії, становить близько п’ятдесяти видів, включаючи яблуню, сливу, виноград, капусту, баклажани, огірок, пшеницю, сою, рис, жито і багато інших сільськогосподарських рослин.
51) геном і каріотип. Каріотип: велика рогата худоба, свині, домашні кури.
Геномом називають всю сукупність спадкового матеріалу, укладеного в гаплоїдному наборі хромосом клітин даного виду організмів. Геном видоспецифічний, так як являє собою той необхідний набір генів, який забезпечує формування видових характеристик організмів в ході їх нормального онтогенезу. Наприклад, у деяких видів з’являються гаплоїдні організми, які розвиваються на основі одинарного набору генів, укладеного в геномі. Так, у ряду видів членистоногих гаплоїдними є самці, що розвиваються з незапліднених яйцеклітин.
При статевому розмноженні в процесі запліднення об’єднуються геноми двох батьківських статевих клітин, утворюючи генотип нового організму. Всі соматичні клітини такого організму мають подвійним набором генів, отриманих від обох батьків у вигляді певних алелів. Таким чином, генотип — це генетична конституція організму, що представляє собою сукупність всіх спадкових задатків його клітин, укладених в їх хромосомному наборі — каріотипі.
Каріотип-диплоїдний набір хромосом, властивий соматичним клітинам організмів даного виду, що є видоспецифічною ознакою і характеризується певним числом, будовою і генетичним складом хромосом.
Каріотип-це набір хромосом соматичної клітини, властивий тому чи іншому виду тварин або рослин. Він включає всі особливості хромосомного комплексу: число хромосом, їх форму, наявність видимих під світловим мікроскопом деталей будови окремих хромосом. Число хромосом в каріотипі завжди парне. Це пояснюється тим, що в соматичних клітинах знаходяться дві однакові за формою і розміром хромосоми – одна з батьківського організму, друга – від материнського.
Число хромосом у деяких видів тварин і людини: велика рогата худоба 60, свиня 38, курка 78 .
Кінець роботи-
Ця тема належить розділу:
Будова хромосом. Аутосоми і статеві хромосоми. Гаплоїдний і диплоїдний набір хромосом
Інбридинг від англійського inbreeding in в всередині breeding розведення один з методів розведення при якому в пари зводять тварин.. Про позитивні і негативні сторони інбридингу постійно ведуться.. Дійсно більшість популяцій диких тварин в природі виникає від однієї пари або декількох особин випадково..
Якщо вам потрібно додатковий матеріал на цю тему, або ви не знайшли те, що шукали, рекомендуємо скористатися пошуком по нашій базі робіт:
Що будемо робити з отриманим матеріалом:
Якщо цей матеріал виявився корисним ля вас, ви можете зберегти його на свою сторінку в соціальних мережах:
твітнути
Всі теми даного розділу:
Гетерозис, його біологічні особливості та причини виникнення
Гетерозис (гібридна потужність, гібридна сила), перевага гібридів першого покоління над батьківськими формами по життєздатності, врожайності, плодючості і ряду інших приз
Використання методів генної інженерії в тваринництві
Застосування методів генної інженерії в тваринництві дозволяє підвищувати продуктивність тварин (наприклад, надої молока), опірність їх організму до хвороб і т. Д. Жи вотних, мають
Сучасне уявлення про ген
Ген — це ділянка молекули днк (у деяких вірусів рнк),що кодує первинну структуру поліпептиду, молекули трнк, ррнк, або взаємодіє з регуляторним білком.ген має дискретну з
Інші живі істоти
* білі блакитноокі коти мають схильність до глухоти. * летальна мутація, що викликає порушення в розвитку хрящів у щурів, призводить до смерті за рахунок великої кількості патологій в різних з
Хромосомна теорія спадковості т. Г. Моргана
Хромосомна теорія спадковості, теорія, згідно з якою хромосоми, укладені в ядрі клітини, є носіями генів і являють собою матеріальну основу спадково
Три альтернативні гіпотези реплікації днк
Консервативна реплікація. Вихідна дволанцюгова молекула днк служить матрицею для утворення абсолютно нової дволанцюгової молекули, націленої на вихідну. При цьому одна з
Докази генетичної ролі днк. Гіпотези (трансформація і трансдукція)
Трансформація-здатність різних штамів бактерій обмінюватися ділянками молекул днк, змінюючи при цьому свої властивості; це включення ділянки днк донора в днк реципієнта.Трансдукція-це
Успадкування ознак, зчеплених з підлогою. Ознаки, обмежені підлогою і залежні від статі
Ознаки, розщеплення за якими при схрещуванні пов’язано з підлогою, називають зчепленими з підлогою. Ці ознаки обумовлюються гена
Закон харді-вайнберга, генна рівновага і методи його визначення
Закон харді-вайнберга. харді і вайнберг провели математичний аналіз розподілу генів у великих популяціях, де немає відбору, мутацій і змішування популяцій. Вони устан
Використання плазмід для отримання рекомбінантних днк
Ген потрібно ввести в клітину таким чином, щоб він не був зруйнований клітинними нуклеазами, а інтегрувався з геномом клітини. Для цього in vitro ген з’єднують з певною днк, що виконує роль про
Правило чистоти гамет (3 закон менделя)
Гомозиготні за генотипом особини мають однакові алельні гени в одному локусі, наприклад вв або bb. У гібридів f1 при повному домінуванні проявляється тільки алель в. Однак у другому по
Процесинг рнк
Між транскрипцією і трансляцією молекула мрнк зазнає ряд послідовних змін, які забезпечують дозрівання функціонуючої матриці для синтезу поліпептидного ланцюжка. До 5-кон
Трансляція
У прокаріотів мрнк може зчитуватися рибосомами в амінокислотну послідовність білків відразу після транскрипції, а у еукаріот вона транспортується з ядра в цитоплазму, де знаходяться рибосоми. Ск
Відбір і методи відбору, використовувані в селекції рослин
Біологічні особливості рослин дозволяють в селекційній роботі з ними використовувати інбридинг, поліплоїдію, штучний мутагенез, віддалену гібридизацію та інші методи. відбір і гиб
Відбір і методи відбору, використовувані в селекції тварин
Методи селекції тварин ті ж, що і методи селекції рослин, але при їх застосуванні селекціонерам доводиться враховувати ряд особливостей, характерних для тварин. Тварини размнож
1 у 1972 р пол берг зі співробітниками опублікували першу роботу про отримання in vitro (поза організмом) рекомбінантної (гібридної) молекули днк, що складається з фрагментів фагової, бактеріальної та вірусної днк. Так народилася нова галузь молекулярної біології, що отримала назву «генетична (генна) інженерія». Своєю метою вона має створення нових генетичних структур і, в кінцевому рахунку, створення організмів з новими спадковими властивостями.
У тому ж році з’явилася перша публікація, в якій повідомлялося про отримання in vitro рекомбінантної днк, що складається з фрагментів різних молекул днк: вірусної, бактеріальної та фагової. Робота була виконана американським вченим полем бергом з співробітниками і ознаменувала народження нової галузі молекулярної біології генетичної (генної) інженерії.
А. А. Баєв був першим в нашій країні вченим, який повірив у перспективність генної інженерії і очолив дослідження в цій галузі. Генетична (генна) інженерія, за його визначенням, це конструювання in vitro функціонально активних генетичних структур (рекомбінантних днк), або створення штучних генетичних програм. Генна інженерія має на меті вивчення механізмів функціонування генетичного апарату.
Інтрони-це ділянки днк, що розбивають експресируемую, тобто кодує частина гена на ділянки, звані екзонами. Вперше феномен існування переривчастих генів був відкритий при вивченні аденовірусу і підтвердився в 1977 р при дослідженні гена глобіну миші і рибосомних генів плодової мушки drosophilla melanogaster. В одному гені може перебувати досить багато інтронів.
В процесі транскрипції рнк-полімераза знімає копію з усього гена. Потім спеціальні сплайсинг-ферменти здійснюють «монтаж «(сплайсинг) транскрипту, вирізують інтрони і» склеюють» екзони один з одним. В результаті чого утворюється зріла, але ще модифікована мрнк.
Малюнок 13. Сегмент генома в процесі транскрипції
Еукаріот, включаючи людину, що іншими прийомами зробити неможливо. Разом з тим, генна інженерія ставить перед собою великі практичні завдання, чимало з яких вже вирішено. Перш за все це отримання шляхом бактеріального синтезу ряду лікарських засобів, наприклад, інсуліну, інтерферонів. Найважливішим досягненням є створення діагностичних препаратів. Отримання так званих трансгенних рослин відкриває принципово нові можливості для рослинництва у створенні сільськогосподарських культур, стійких до екстремальних впливів та інфекційних уражень. Це далеко не повний перелік практичних звершень генної інженерії.
Після перших успішних експериментів з рекомбінацією молекул днк в пробірці з’явилися перші сумніви і побоювання, чи не принесе генна інженерія шкоди природі і людству. У липні 1974 року кілька великих вчених звернулися до наукової громадськості з пропозицією накласти мораторій на роботи з рекомбінантними днк in vitro. У лютому 1975 року в каліфорнії на асіломарской конференції зібралися 140 вчених різних країн, що працюють в області генної інженерії. Всебічно вивчивши результати і можливі наслідки, вчені прийшли до висновку, що потенційні небезпеки невеликі, так як рекомбінантні штами в природних умовах нежиттєздатні і їх безконтрольне поширення малоймовірно. Було вирішено
Перервати мораторій і продовжити дослідження з дотриманням спеціально розроблених правил. Сьогодні ми можемо відзначити, що майже за чверть століття свого існування генна інженерія не заподіяла ніякої шкоди самим дослідникам, не принесла шкоди ні природі, ні людині. Звершення генної інженерії як в пізнанні механізмів функціонування організмів, так і в прикладному плані досить значні, а перспективи воістину фантастичні.
Молекулярна біологія заявила про себе в якості самостійної науки в 1953 році, коли джеймс уотсон і френсіс крик відкрили знамениту подвійну спіраль днк і постулювали матричний механізм її синтезу.
Відповідно до цього механізму подвійна спіраль днк при реплікації розділяється і кожен ланцюг служить матрицею для синтезу дочірнього ланцюга, яка за своєю первинною структурою є дзеркальним відображенням матриці (рис. 14). В результаті такого матричного синтезу утворюються дві абсолютно ідентичні двуспіральние молекули днк, кожна з яких передається в дочірні клітини. Останні отримують всю генетичну програму від батьківської клітини. За таким же матричним механізмом здійснюється синтез рнк, тільки рнк синтезується у вигляді односпірального ланцюга, яка комплементарна днк-матриці.
Малюнок 14. Транскрипція днк
Цей процес отримав назву транскрипції. А процес і синтезу білка на рнк-матриці (м-рнк) відбувається на рибосомах, і структура білка відповідає структурі м-рнк. Це дуже складний процес, він називається трансляцією (мал. 14), і в ньому бере участь транспортна рнк (т-рнк). Вона доставляє в рибосому аміноксилоти і адаптує мову м-рнк до мови білка. Таким чином, процес матричного синтезу днк визначає передачу спадкової інформації від батьківської клітини в дочірню. У процесі матричного синтезу рнк відбувається передача інформації (генетичного коду даного білка) від днк на м-рнк, а м-рнк переносить інформацію на рибосому, де вона реалізується у вигляді конкретної структури білка.
При статевому процесі може відбуватися обмін ділянками між двома хромосомами (молекулами днк) від двох схрещуваних індивідуумів. Цей процес отримав назву рекомбінація, і в клітині найчастіше він може відбуватися тільки між гомологічними хромосомами, так як комплементарні за своєю структурою молекули днк притягуються один до одного і обмінюються генетичними детермінантами, в результаті чого утворюється дочірня хромосома, що містить елементи структури від двох батьківських хромосом. Відкритий нещодавно процес негомологічної рекомбінації здійснюється тільки в тому випадку, якщо в одній з взаємодіючих молекул днк є гени, що кодують спеціальні ферменти розрізання днк.
Малюнок 15. Схема організації хромосомного матеріалу
Наступне важливе відкриття, що зумовило виникнення генної інженерії, виявлення в бактеріальних клітинах позахромосомних маленьких кільцевих молекул днк. Ці мініхромосоми вперше були виявлені на початку 50-х років і отримали назву плазмід. Плазміди мають здатність до автономної від хромосоми реплікації, тому плазміди содрежатся в клітці у вигляді декількох копій. Розрізняються плазміди по генетичним детермінантам. Дуже важливо, що плазміди через своїх малих розмірів можуть бути виділені з клітини в неушкодженому, нативному стані.
У 1970 році американці келлі і сміт з співробітниками виділили першу рестриктазу фермент, який викликає гідроліз днк в строго визначених місцях з утворенням так званих липких кінців.Існування таких ферментів-рестриктаз було доведено в дослідах швейцарців лінна і арбера в кінці 60-х років. В даний час описано безліч таких ферментів, які застосовуються в генній інженерії.
Таким чином, до початку 70-х років були сформульовані основні принципи функціонування нуклеїнових кислот і білків в живому організмі і створені теоретичні передумови генної інженерії.
2 як уже зазначалося, процес рекомбінації в організмі (in vivo) можливий в більшості випадків між гомологічними молекулами днк. Однак виявилося, що in vitro притягання і взаємодія (гібридизація) молекул днк можливо, якщо вони будуть мати невеликі комплементарні односпіральні ділянки з чотирьох і більше нуклеотидів на кінцях молекул (в даний час описані дванадцятинуклеотидні липкі кінці). Такі комплементарні односпіральні послідовності отримали назву липких кінців, так як дві молекули днк можуть з’єднатися (злипнутися) цими кінцями. Таким чином, якщо в пробірку помістити найрізноманітніші молекули днк з однаковими липкими кінцями, то буде відбуватися рекомбінація, навіть якщо вся їх структура дуже різниться.
Як же отримати гетерогенні молекули днк з однаковими липкими кінцями? для цього використовуються ферменти-рестриктази, які» вміють » розрізати молекули днк так, що у них утворюються однакові (комплементарні) липкі кінці. Відбувається таке розрізання в ділянках, що несуть особливим чином повторювані послідовності нуклеотидів. Рестриктази пізнають ці послідовності і розрізають днк в точках повтору: в результаті односпіральний кінець однієї молекули виявляється комплементарним (липким) кінця іншої молекули.
Тепер, щоб отримані в пробірці генні конструкції запрацювали, необхідно їх ввести в відповідну бактеріальну клітину. Ось тут-то і знадобляться плазміди. У генній інженерії їх називають векторами (вози, які доставляють в клітину клонований ген). Для цього плазміди теж ріжуть рестриктазами, щоб отримати односпіральні кінці, комплементрание кінців генів, проводять гібридизацію гена і плазміди в пробірці, а потім рекомбінантну плазміду (її називають ще химерної) вводять в клітину. Плазміди, які використовуються в генній інженерії, мають дуже важливу властивість: вони містять так званий маркерний ген, наприклад ген, що повідомляє клітині стійкість до певного антибіотика. Завдяки цьому клітини, що несуть рекомбінантну плазміду, легко відокремити від клітин, які не мають такої плазміди. Для цього бактерії висівають на середовище з антибіотиком, на якій будуть рости тільки клітини з плазмідою – так звані рекомбінантні клітини, а процедура їх відбору отримала назву молекулярного клонування, так як рекомбінантні клітини являють собою потомство однієї молекули днк.
У рекомбінантних клітинах химерна плазміда, що несе чужорідний ген, починає функціонувати, тобто відбуваються процеси реплікації, транскрипції і трансляції нового введеного в клітину гена і синтезується продукт цього гена, який в природних клітинах ніколи раніше не міг утворитися. Таким чином, in vitro проводиться тільки рекомбінація, а всі інші перетворення з химерної плазмідою відбуваються в клітці так само, як і зі своїми власними генами. Іншими словами, тепер можна ввести в бактеріальну клітину ген, отриманий з будь-якого організму, і змусити чужорідний ген там функціонувати.
Отже, основні процедури в генній інженерії зводяться до наступного (рис. 16):
1) рекомбінація in vitro днк-вектора і днк – гена;
2) введення рекомбінантної плазміди в клітину;
3) молекулярне клонування.
Малюнок 16. Принципова схема маніпуляції генної інженерії
11 липня 2008
Генна інженерія (генетична інженерія) – сукупність методів і технологій, в тому числі технологій отримання рекомбінантних рибонуклеїнових і дезоксирибонуклеїнових кислот, по виділенню генів з організму, здійсненню маніпуляцій з генами і введенню їх в інші організми .
Генна інженерія-складова частина сучасної біотехнології, теоретичною основою її є молекулярна біологія, генетика. Суть нової технології полягає в направленому, за заздалегідь заданою програмою конструюванні молекулярних генетичних систем поза організмом (in vitro) з подальшим впровадженням створених конструкцій в живий організм. В результаті досягається їх включення і активність в даному організмі і у його потомства. Можливості генної інженерії-генетична трансформація, перенесення чужорідних генів та інших матеріальних носіїв спадковості в клітини рослин, тварин і мікроорганізмів, отримання генно-інженерно-модифікованих (генетично модифікованих, трансгенних) організмів з новими унікальними генетичними, біохімічними і фізіологічними властивостями і ознаками, роблять цей напрямок стратегічним.
З точки зору методології генна інженерія поєднує в собі фундаментальні принципи (генетика, клітинна теорія, молекулярна біологія, системна біологія), досягнення найсучасніших постгеномних наук: геноміки, метаболоміки, протеоміки з реальними досягненнями в прикладних напрямках: біомедицина, агробіотехнологія, біоенергетика, біофармакологія, біоіндустрія і т.д.
Генна інженерія відноситься (поряд з біотехнологією, генетикою, молекулярною біологією, та низкою інших наук про життя) до сфери природничих наук.
Історична довідка
Генна інженерія з’явилася завдяки роботам багатьох дослідників у різних галузях біохімії та молекулярної генетики. У 1953 році дж. Уотсон і ф.крік створили двоспіральну модель днк, на рубежі 50 – 60-х років 20 століття були з’ясовані властивості генетичного коду, а до кінця 60-х років його універсальність була підтверджена експериментально. Йшло інтенсивний розвиток молекулярної генетики, об’єктами якої стали e. Coli, її віруси і плазміди. Були розроблені методи виділення високоочищених препаратів непошкоджених молекул днк, плазмід і вірусів. Днк вірусів і плазмід вводили в клітини в біологічно активній формі, забезпечуючи її реплікацію і експресію відповідних генів. У 1970 році г.смітом був вперше виділений ряд ферментів – рестриктаз, придатних для генно-інженерних цілей. Г. Сміт встановив, що отриманий з бактерій очищений фермент hindii зберігає здатність розрізати молекули нуклеїнових кислот (нуклеазна активність), характерну для живих бактерій. Комбінування днк-рестриктаз (для розрізання молекул днк на певні фрагменти) і виділених ще в 1967 р. Ферментів-днк-лігаз (для» зшивання » фрагментів в довільній послідовності) по праву можна вважати центральною ланкою в технології генної інженерії.
Таким чином, до початку 70-х років були сформульовані основні принципи функціонування нуклеїнових кислот і білків в живому організмі і створені теоретичні передумови генної інженерії
Академік а.а. Баєв був першим в нашій країні вченим, який повірив у перспективність генної інженерії і очолив дослідження в цій галузі. Генетична інженерія – за його визначенням) – конструювання in vitro функціонально активних генетичних структур (рекомбінантних днк), або інакше-створення штучних генетичних програм.
Завдання і методи генної інженерії
Добре відомо, що традиційна селекція має цілий ряд обмежень, які перешкоджають отриманню нових порід тварин, сортів рослин або рас практично цінних мікроорганізмів:
1. Відсутність рекомбінації у неспоріднених видів. Між видами існують жорсткі бар’єри, що ускладнюють природну рекомбінацію.
2. Неможливість керувати процесом рекомбінації в організмі ззовні. Відсутність гомології між хромосомами призводить до нездатності зближуватися і обмінюватися окремими ділянками (і генами) в процесі утворення статевих клітин. В результаті стає неможливим перенесення потрібних генів і забезпечення оптимального поєднання в новому організмі генів, отриманих від різних батьківських форм;
3. Неможливість точно задати ознаки і властивості потомства, тому що процес рекомбінації – статистичний.
Природні механізми, що стоять на сторожі чистоти і стабільності генома організму, практично неможливо подолати методами класичної селекції.
Технологія отримання генетично модифікованих організмів (гмо) принципово вирішує питання подолання всіх природних і міжвидових рекомбінаційних і репродуктивних бар’єрів. На відміну від традиційної селекції, в ході якої генотип піддається змінам лише побічно, генна інженерія дозволяє безпосередньо втручатися в генетичний апарат, застосовуючи техніку молекулярного клонування. Генна інженерія дозволяє оперувати будь-якими генами, навіть синтезованими штучно абоНалежать не спорідненим організмам, переносити їх від одного виду до іншого, комбінувати в довільному порядку.
Технологія включає кілька етапів створення гмо:
1. Отримання ізольованого гена.
2. Введення гена в вектор для вбудовування в організм.
3. Перенесення вектора з конструкцією в модифікований організм-рецепт.
4. Молекулярне клонування.
5. Відбір гмо.
Перший етап-синтез, виділення та ідентифікація цільових фрагментів днк або рнк і регуляторних елементів дуже добре розроблений і автоматизований. Ізольований ген може бути також отриманий з фагової бібліотеки.
Другий етап-створення in vitro (в пробірці) генетичної конструкції (трансгена), яка містить один або кілька фрагментів днк (кодують послідовність амінокислот білків) в сукупності з регуляторними елементами (останні забезпечують активність трансгенів в організмі). Далі трансгени вбудовують в днк вектора для клонування, використовуючи інструментарій генної інженерії-рестриктази і лігази. За відкриття рестриктаз вернер арбер, даніел натанс і хамілтон сміт були удостоєні нобелівської премії (1978 р.). Як правило, в якості вектора використовують плазміди – невеликі кільцеві молекули днк бактеріального походження.
Наступний етап-власне «генетична модифікація «(трансформація), тобто перенесення конструкції» вектор – вбудована днк» в окремі живі клітини. Введення готового гена в спадковий апарат клітин рослин і тварин являє собою складну задачу, яка була вирішена після вивчення особливостей впровадження чужорідної днк (вірусу або бактерії) в генетичний апарат клітини. Процес трансфекції був використаний як принцип введення генетичного матеріалу в клітину.
Якщо трансформація пройшла успішно, то після ефективної реплікації з однієї трансформованої клітини виникає безліч дочірніх клітин, що містять штучно створену генетичну конструкцію. Основою для появи у організму нової ознаки служить біосинтез нових для організму білків-продуктів трансгену, наприклад, рослин-стійкості до посухи або комах-шкідників у гм рослин.
Для одноклітинних організмів процес генетичної модифікації обмежується вбудовуванням рекомбінантної плазміди з подальшим відбором модифікованих нащадків (клонів). Для вищих багатоклітинних організмів, наприклад, рослин, то обов’язковим є включення конструкції в днк хромосом або клітинних органел (хлоропластів, мітохондрій) з подальшою регенерацією цілої рослини з окремої ізольованої клітини на поживних середовищах. У випадку тварин, клітини зі зміненим генотипом вводять в бластоциди сурогатної матері. Перші гм рослини були отримані в 1982 році вченими з інституту рослинництва в кельні і компанії monsanto.
Основні напрямки
Постгеномная ера в першій декаді xxi-ого століття підняла на новий рівень розвиток генної інженерії. Так званий кельнський протокол «на шляху до біоекономіки, заснованої на знаннях«, визначив біоекономіку як»перетворення знань наук про життя в нову, стійку, екологічно ефективну і конкурентоспроможну продукцію». Дорожня карта генної інженерії містить цілий ряд напрямків: генотерапія, біоіндустрія, технології, засновані на стовбурових клітинах тварин, гм рослини, гм тварини і т. Д.
Генетично модифіковані рослини
Ввести чужорідну днк в рослини можна різними способами.
Для дводольних рослин існує природний вектор для горизонтального перенесення генів: плазміди. Що стосується однодольних, то, хоча в останні роки досягнуті певні успіхи в їх трансформації, все ж подібний шлях трансформації зустрічає істотні труднощі.
Для трансформації стійких до агробактеріям рослин розроблені прийоми прямого фізичного перенесення днк в клітину вони включають: бомбардування мікрочастинками або балістичний метод; електропорацію; обробку поліетиленгліколем; перенесення днк в складі ліпосом і ін.
Після проведення тим чи іншим способом трансформації рослинної тканини її поміщають in vitro на спеціальне середовище з фітогормонами, що сприяє розмноженню клітин. Середовище зазвичай містить селективний агент, щодо якого трансгенні, але не контрольні клітини набувають стійкість. Регенерація найчастіше проходить через стадію каллуса, після чого при правильному підборі середовищ починається органогенез (побегообразование). Сформовані пагони переносять на середовище вкорінення, часто також містить селективний агент для більш суворого відбору трансгенних особин.
Перші трансгенні рослини (рослини тютюну з вбудованими генами з мікроорганізмів) були отримані в 1983 р перші успішні польові випробування трансгенних рослин (стійкі до вірусної інфекції рослини тютюну) були проведені в сша вже в 1986 р.
Після проходження всіх необхідних тестів на токсичність, алергенність, мутагенність і т.д. Перші трансгенні продукти з’явилися у продажу в сша в 1994 р це були томати flavr savr з уповільненим дозріванням, створені фірмою «calgen», а також гербіцид-стійка соя компанії «monsanto». Вже через 1-2 роки біотехнологічні фірми поставили на ринок цілий ряд генетично змінених рослин: томатів, кукурудзи, картоплі, тютюну, сої, ріпаку, кабачків, редису, бавовнику.
У рф можливість отримання трансгенної картоплі методом бактеріальної трансформації з використанням agrobacterium tumefaciens була показана в 1990 р
В даний час отриманням і випробуванням генетично модифікованих рослин займаються сотні комерційних фірм у всьому світі з сукупним капіталом понад 100 мільярдів доларів. Генно-інженерна біотехнологія рослин вже стала важливою галуззю виробництва продовольства та інших корисних продуктів, що залучає значні людські ресурси і фінансові потоки.
В росії під керівництвом академіка к. Г. Скрябіна (центр «біоінженерія» ран) отримані і охарактеризовані гм сорти картоплі єлизавета плюс і луговський плюс, стійкі до колорадського жука. За результатами перевірки федеральною службою з нагляду у сфері захисту прав споживачів і благополуччя людини на підставі експертного висновку гу нді харчування рамн дані сорти пройшли державну реєстрацію, внесені до державного реєстру і дозволені для ввезення, виготовлення та обігу на території рф.
Дані гм сорту картоплі принципово відрізняється від звичайних наявністю в його геномі вбудованого гена, що визначає 100%-ю захист врожаю від колорадського жука без використання будь-яких хімічних засобів.
Перша хвиля трансгенних рослин, допущених для практичного застосування, містила додаткові гени стійкості (до хвороб, гербіцидів, шкідників, псування при зберіганні, стресів).
Нинішній етап розвитку генетичної інженерії рослин отримав назву «метаболічна інженерія». При цьому ставиться завдання не стільки поліпшити ті чи інші наявні якості рослини, як при традиційній селекції, скільки навчити рослину виробляти абсолютно нові сполуки, використовувані в медицині, хімічному виробництві та інших областях. Цими сполуками можуть бути, наприклад, особливі жирні кислоти, корисні білки з високим вмістом незамінних амінокислот, модифіковані полісахариди, їстівні вакцини, антитіла, інтерферони та інші «лікарські» білки, нові полімери, що не засмічують навколишнє середовище і багато, багато іншого. Використання трансгенних рослин дозволяє налагодити масштабне і дешеве виробництво таких речовин і тим самим зробити їх більш доступними для широкого споживання.
Генетично модифіковані тварини
Клітини тварин істотно відрізняються від бактеріальних за своєю здатністю поглинати чужорідну днк, тому методи і способи способи введення генів в ембріональні клітини ссавців, мух і риб залишаються в центрі уваги генних інженерів.
Найбільш вивчене в генетичному відношенні ссавець – миші. Перший успіх відноситься до 1980 року, коли д. Гордон з співробітниками продемонстрував можливість введення та інтеграції чужорідної днк в геном мишей. Інтеграція була стабільною і зберігалася у потомства. Трансформацію виробляють мікроін’єкцією клонованих генів в один або обидва пронуклеуса (ядра) тільки що ембріона на стадії однієї клітини (зиготи). Найчастіше вибирають чоловічий пронуклеус, привнесений сперматозоїдом, так як його розміри більше. Після ін’єкції яйцеклітину негайно імплантують в яйцепровід прийомної матері, або дають можливість розвиватися в культурі до стадії бластоцисти, після чого імплантують в матку.
Таким чином були ін’єктовані гени інтерферону та інсуліну людини, ген β-глобінуКролика, ген тимідинкінази вірусу простого герпесу і кднк вірусу лейкемії мишей. Число молекул, що вводиться за одну ін’єкцію, коливається від 100 до 300 000, а їх розмір – від 5 до 50 кб. Виживає зазвичай 10-30% яйцеклітин, а частка мишей, що народилися з трансформованих яйцеклітин варіює від декількох до 40%. Таким чином, реальна ефективність становить близько 10%.
Таким методом отримані генно-інженерні щури, кролики, вівці, свині, кози, телята та інші ссавці. У нашій країні отримані свині, що несуть ген соматотропіну. Вони не відрізнялися за темпами зростання від нормальних тварин, але зміна обміну речовин позначилося на вмісті жиру. У таких тварин інгібувалися процеси ліпогенезу і активувався синтез білка. До зміни обміну речовин призводило і вбудовування генів інсуліноподібного фактора. Гм свині були створені для вивчення ланцюжка біохімічних перетворень гормону, а побічним ефектом стало зміцнення імунної системи.
Найпотужніша білоксинтезуюча система знаходиться в клітинах молочної залози. Якщо поставити гени чужих білків під контроль казеїнового промотору, то експресія цих генів буде потужною і стабільною, а білок буде накопичуватися в молоці. За допомогою тварин-біореакторів (трансгенні корови) вже отримано молоко, в якому міститься людський білок лактоферрин. Цей білок планується застосовувати для профілактики гастроентерологічних захворювань у людей з низькою імунорезистентністю: хворі на снід, недоношені немовлята, хворі на рак, які пройшли радіотерапію.
Важливий напрямок трансгенозу – отримання стійких до хвороб тварин. Ген інтерферону, що відноситься до захисних білків, вбудовували різним тваринам. Трансгенні миші отримали стійкість-вони не хворіли або хворіли мало, а ось у свиней такого ефекту не виявлено.
Застосування в наукових дослідженнях
Нокаут гена (gene knockout) – техніка видалення одного або більшої кількості генів, що дозволяє досліджувати функції гена. Для отримання нокаутних мишей отриману генно-інженерну конструкцію вводять в ембріональні стовбурові клітини, де конструкція піддається соматичної рекомбінації і заміщає нормальний ген, а змінені клітини імплантують в бластоцист сурогатної матері. Подібним способом отримують нокаут у рослин і мікроорганізмів.
Штучна експресія-додавання в організм гена, якого у нього раніше не було, також з цілями вивчення функції генів. Візуалізація продуктів генів-використовується для вивчення локалізації продукту гена. Заміщення нормального гена на сконструйований ген, злитий з репортерним елементом, (наприклад, з геном зеленого флуоресцентного білка) забезпечує візуалізацію продукту генної модифікації.
Дослідження механізму експресії. Невелику ділянку днк, розташований перед кодує областю (промотор) і службовець для зв’язування факторів транскрипції, вводять в організм, поставивши після нього замість власного гена репортерний, наприклад, gfp, каталізує легко виявляється реакцію. Крім того, що функціонування промотору в тих чи інших тканинах в той чи інший момент стає добре помітним, такі експерименти дозволяють досліджувати структуру промотору, прибираючи або додаючи до нього фрагменти днк, а також штучно посилювати експресію генів.
Біобезпека генно-інженерної діяльності
Ще в 1975 р вчені всього світу на асіломарской конференції підняли найважливіше питання: чи не зробить поява гмо потенційно негативного впливу на біологічне різноманіття? з цього моменту одночасно з бурхливим розвитком генної інженерії стало розвиватися новий напрямок — біобезпека. Головне її завдання-оцінити чи не несе використання гмо небажаний вплив на навколишнє середовище, здоров’я людини і тварин, а головна мета — відкрити шлях до використання досягнень сучасної біотехнології, гарантуючи при цьому безпеку.
Стратегія біобезпеки ґрунтується на науковому дослідженні особливостей гмо, досвіді поводження з ним, а також інформації про його передбачуване використання та навколишнє середовище, в яке він буде інтродукований. Спільними багаторічними зусиллями міжнародних організацій (юнеп, вооз, оеср), експертів з різних країн, в т.ч. Росії, були розроблені базові поняття і процедури: біологічна безпека, біологічна небезпека, ризик, оцінка ризиків. Тільки після того, як повний цикл перевірок буде успішно здійснений, готується науковий висновок про біобезпеку гмо. У 2005 р. Вооз опублікувало доповідь, згідно з якою вживання зареєстрованих в якості їжі гм рослин також безпечно, як їх традиційних аналогів.
Як забезпечується біобезпека в росії? початком включення росії в світову систему біобезпеки можна вважати ратифікацію «конвенції про біорізноманіття» в 1995 році. З цього моменту почалося формування національної системи біобезпеки, відправною точкою якої стало набуття чинності федерального закону рф «про державне регулювання в галузі генно-інженерної діяльності» (1996 р.). Фз встановлює основні поняття і принципи державного регулювання і контролю всіх видів робіт з гмо. Фз встановлює рівні ризику в залежності від типу гмо і виду робіт, дає визначення замкнутої і відкритої систем, випуску гмо і т.д.
За минулі роки в росії сформувалася одна з найжорсткіших систем регулювання. Неординарний той факт, що система державного регулювання гмо стартувала превентивно, в 1996 році, до того, як реальні генно-інженерні організми були заявлені для комерціалізації на території росії (перший гмо – гм соя — була зареєстрована для харчового використання в 1999р.). Базовими правовими інструментами служать державна реєстрація генно-інженерно-модифікованих організмів, а також продукції, отриманої з них або їх містить, призначених для використання в якості їжі і кормів.
Для розуміння сучасної ситуації важливий факт, що протягом 25 років, що минули з моменту першого виходу гм рослин на ринок, не виявлено жодного достовірного негативного впливу їх на довкілля та здоров’я людини і тварин ні в ході випробувань, ні при комерційному використанні. Тільки в одному зі світових джерел-звіті авторитетного товариства agbios «essential biosafety» міститься більше 1000 посилань на дослідження, які доводять, що їжа і корми, отримані з біотехнологічних культур, настільки ж безпечні, наскільки безпечні і традиційні продукти. Однак на сьогоднішній день в росії відсутня нормативно-правова база, яка дозволила б здійснювати на території нашої країни випуск в навколишнє середовище гм рослин, а також продукції, отриманої з них або їх містить. Як наслідок-на 2010 рік жодне гм рослина не вирощується на території російської федерації в комерційних цілях.
За прогнозом, згідно з кельнським протоколом (2007 р), до 2030 р ставлення до сільськогосподарських гм культур зміниться в бік схвалення їх використання.
Досягнення та перспективи розвитку
Генна інженерія в медицині
Потреби охорони здоров’я, необхідність вирішення проблем старіння населення формують стійкий попит на генно-інженерні фармпрепарати (з річним обсягом продажів в 26 млрд.дол. Сша) і лікувально-косметичні засоби з рослинної і тваринної сировини (з річним обсягом продажів близько 40 млрд.дол. Сша).
Серед багатьох досягнень генної інженерії, які отримали застосування в медицині, найбільш значне – отримання людського інсуліну в промислових масштабах.
В даний час за даними вооз в світі налічується близько 110 млн.людей, які страждають на діабет. Інсулін, ін’єкції якого показані хворим на це захворювання, вже давно отримують з органів тварин і використовують в медичній практиці. Однак багаторічне застосування тваринного інсуліну веде до незворотного ураження багатьох органів пацієнта через імунологічних реакцій, що викликаються ін’єкцією чужорідного людському організму тварини інсуліну. Але навіть потреби в тваринному інсуліні до недавнього часу задовольнялися всього на 60-70%. Генні інженери в якості першого практичного завдання клонували ген інсуліну. Клоновані гени людського інсуліну були введені з плазмідою в бактеріальну клітину, де почався синтез гормону, який природні мікробні штами ніколи не синтезували. Починаючи з 1982 року фірми сша, японії, великобританії та інших країн виробляють генно-інженерний інсулін. У росії отримання генно-інженерного людського інсуліну-інсурану ведеться в інституті біоорганічної хімії ім. М. М. Шемякіна і ю.а. Овчиннікова ран. Сьогодні вітчизняний інсулін виробляється в обсязі, достатньому для забезпечення хворих на діабет м москви. Разом з тим, потребаВсього російського ринку в генно-інженерному інсуліні задовольняється, в основному, імпортними поставками. Світовий ринок інсуліну складає в даний час більше 400 млн. Доларів, щорічне споживання близько 2500 кг.
Розвиток генної інженерії в 80-х роках минулого століття забезпечило хороший заділ росії в створенні генно-інженерних штамів мікроорганізмів із заданими властивостями-продуцентів біологічно активних речовин, в розробці генно-інженерних методів реконструювання генетичного матеріалу вірусів, в отриманні лікарських субстанцій, в тому числі і з використанням комп’ютерного моделювання. До стадії виробництва доведені рекомбінантний інтерферон і лікарські форми на його основі медичного та ветеринарного призначення, інтерлейкін (b-лейкін), еритропоетин. Незважаючи на зростаючий попит на високоочищені препарати, вітчизняне виробництво імуноглобулінів, альбуміну, плазмола забезпечує 20% потреб внутрішнього ринку.
Активно ведуться дослідження з розробки вакцин для профілактики і лікування гепатитів, сніду і ряду інших захворювань, а також кон’югованих вакцин нового покоління проти найбільш соціально значущих інфекцій. Полімер-субодиничні вакцини нового покоління складаються з високоочищених протективних антигенів різної природи і носія – імуностимулятора поліоксидонію, що забезпечує підвищений рівень специфічної імунної відповіді. Щеплення проти переважної більшості відомих інфекцій росія могла б забезпечити на базі власного імунологічного виробництва. Повністю відсутня тільки виробництво вакцини проти краснухи.
Генна інженерія для сільського господарства
Генетичне поліпшення сільськогосподарських культур і декоративних рослин являє собою тривалий і безперервний процес з використанням все більш точних і передбачуваних технологій. У науковому звіті оон (за 1989 рік) сказано наступне: «оскільки молекулярні методи найбільш точні, ті, хто їх застосовує, більшою мірою впевнені в тому, якими ознаками вони наділяють рослини, і, отже, рідше отримують незаплановані ефекти, ніж при використанні звичайних методів селекції.»
Переваги нових технологій вже широко використовуються в таких країнах, як сша, аргентина, індія, китай і бразилія, де генетично модифіковані культури обробляють на великих територіях.
Нові технології також мають велике значення для незаможних фермерів і жителів бідних країн, особливо жінок і дітей. Наприклад, генетично модифіковані, стійкі до шкідників, бавовник і кукурудза вимагають застосування інсектицидів в значно менших обсягах (що робить працю на фермі більш безпечним). Такі культури сприяють підвищенню врожайності, отриманню фермерами більш високих доходів, зниженню рівня бідності та ризику отруєння населення хімічними пестицидами, що особливо характерно для ряду країн, у тому числі для індії, китаю, пар і філіппін.
Найпоширенішими гм рослинами є культури, стійкі до недорогих, найменш токсичним і найбільш широко використовуваним гербіцидів. Обробіток таких культур дозволяє отримувати більш високий урожай з гектара, позбутися від виснажливої ручної прополки, витрачати менше коштів за рахунок мінімальної або безоральної обробки землі, що, в свою чергу, призводить до зниження ерозії грунту.
У 2009 році відбулася заміна генетично модифікованих культур першого покоління продуктами другого покоління, що вперше призвело до збільшення врожайності per se. Приклад біотехнологічної культури нового класу – над створенням якої працювали багато дослідників) — стійка до гліфосату соя rready2yield™ , вирощувалася в 2009 році в сша і канаді більш ніж на 0.5 мільйонах га.
Впровадження генної інженерії в сучасну агробиологию може бути проілюстровано такими фактами з ряду зарубіжних експертних оглядів, у тому числі щорічного огляду незалежної міжнародної служби моніторингу за застосуванням агробіотехнології (іѕааа), очолюваної відомим у світі експертом клайвом джеймсом (claiv james): (www.isaaa.org)
У 2009 році в 25 країнах світу вирощували гм культури на площі 134 млн. Га (що становить 9% від 1,5 млрд. Га всіх орних земель у світі). Шість країн єс (27) обробляли bt кукурудзу, і в 2009 році площі її посівів досягли понад 94 750 га. Аналіз світового економічного ефекту використання біотехнологічних культур за період з 1996 по 2008 р. Показує зростання прибутку в розмірі 51,9 мільярдів доларів завдяки двох джерел: по-перше, це скорочення виробничих витрат (50%) і, по-друге, значна прибавка врожаю (50%) в розмірі 167 мільйонів тонн.
У 2009 році загальна ринкова вартість насіння гм культур у світі склала 10.5 мільярдів доларів. Загальна вартість по зерну біотех кукурудзи та сої, а також бавовнику в 2008 році склала 130 млрд.доларів, і очікується, що її щорічне зростання складе 10 – 15%.
Підраховано, що в разі повного прийняття біотехнології, до кінця періоду 2006-2015 р. Прибуток всіх країн в перерахунку на ввп зросте на 210 млрд. Дол. Сша на рік.
Спостереження, що проводяться з початку застосування в сільському господарстві стійких до гербіцидів сільськогосподарських культур, переконливо доводять, що фермери отримали можливість більш ефективно боротися з бур’янами. При цьому розпушування і розорювання полів втрачають своє значення як засобу боротьби з бур’янами. В результаті знижується витрата тракторного палива, поліпшується структура грунту і запобігає її ерозія. Цільові інсектицидні програми вирощування bt бавовнику передбачають меншу кількість обприскувань посівів і, отже, меншу кількість виїздів техніки на поля, що призводить до скорочення ерозії грунтів. Все це мимоволі сприяє впровадженню консервуючої технології обробки грунту, спрямованої на зниження грунтової ерозії, рівня вуглекислого газу і зменшення втрати води.
Для сучасного стану науки характерний комплексний підхід, створення єдиних технологічних платформ для проведення широкого спектру досліджень. Вони об’єднують не тільки біотехнологію, молекулярну біологію і генну інженерію, але також і хімію, фізику, біоінформатику, транскриптоміку, протеоміку, метаболоміку.
Рекомендована література
1. Дж. Уотсон. Молекулярна біологія гена. М.: світ. 1978.
2. Стент г., келіндар р. Молекулярна генетика. М.: світ. 1981
3. С. Н. Щелкунов»генетична інженерія». Новосибірськ, видавництво сибірського університету, 2008
4. Глік б. Молекулярна біотехнологія. Принципи і застосування / б. Глік, дж. Пастернак. М.: світ, 2002
5. Генна інженерія рослин. Лабораторне керівництво. Під редакцією дж. Дрейпера, р. Скотта, ф.армітіджа, р. Уолдена. М. « «мир». 1991.
6. Агробиотехнология в світі. За ред. Скрябіна к.г. М.: центр «біоінженерія» ран, 2008. — 135 с.
7. Кларк. Д., рассел л. Молекулярна біологія простий і цікавий підхід. М.: зат «компанія конд». 2004
Посилання
1. «про державне регулювання генно-інженерної діяльності»» фз-86 в ред. 2000 р, ст. 1
2. Кельнський протокол, cologne paper, прийнятий на конференції » на шляху до біоекономіки, заснованої на знаннях» (кельн, 30 травня 2007 р.), організованої європейським союзом в період президентства німеччини в єс.