Санітарно-мікробіологічне дослідження повітря можна розділити на 4 етапи:
1) відбір проб;
2) обробка, транспортування, зберігання проб, отримання концентрату мікроорганізмів (якщо необхідно);
3) бактеріологічний посів, культивування мікроорганізмів;
4) ідентифікація виділеної культури.
Відбір проб, як і при дослідженні будь-якого об’єкта, є найбільш відповідальним. Правильне взяття проб гарантує точність дослідження. У закритих приміщеннях точки відбору проб встановлюються з розрахунку на кожні 20 м 2 площі — одна проба повітря, за типом конверта: 4 точки по кутах кімнати (на відстані 0,5 м від стін) і 5-я точка — в центрі. Проби повітря забираються на висоті 1,6-1,8 м від підлоги — на рівні дихання в житлових приміщеннях. Проби необхідно відбирати вдень (в період активної діяльності людини), після вологого прибирання і провітрювання приміщення. Атмосферне повітря досліджують в житловій зоні на рівні 0,5-2 м від землі поблизу джерел забруднення, а також в зелених зонах (парки, сади і т.д.) для оцінки їх впливу на мікрофлору повітря.
Слід звернути увагу на те, що при відборі проб повітря в багатьох випадках відбувається посів його на живильне середовище.
Всі методи відбору проб повітря можна розділити на седиментаційні та аспіраційні.
Седиментаційний-найбільш старий метод, широко поширений завдяки простоті і доступності, проте є неточним. Метод запропонований р. Кохом і полягає в здатності мікроорганізмів під дією сили тяжіння і під впливом руху повітря (разом з частинками пилу і крапельками аерозолю) осідати на поверхню живильного середовища у відкриті чашки петрі. Чашки встановлюються в точках відбору на горизонтальній поверхні. При визначенні загальної мікробної обсіменіння чашки з мясопептонним агаром залишають відкритими на 5-10 хв або довше в залежності від ступеня передбачуваного бактеріального забруднення. Для виявлення санітарно-показових мікробів застосовують середовище гарро або туржецького (для виявлення стрептококів), молочно-сольовий або желточно-сольовий агар (для визначення стафілококів), суслоагар або середу сабуро (для виявлення дріжджів і грибів). При визначенні санітарно-показових мікроорганізмів чашки залишають відкритими протягом 40-60 хв.
Після закінчення експозиції всі чашки закривають, поміщають в термостат на добу для культивування при температурі, оптимальній для розвитку виділяється мікроорганізму, потім (якщо цього вимагають дослідження) на 48 год залишають при кімнатній температурі для утворення пігменту пигментообразующими мікроорганізмами.
Седиментаційний метод має ряд недоліків: на поверхню середовища осідають тільки грубодисперсні фракції аерозолю; нерідко колонії утворюються не з одиничної клітини, а зі скупчення мікробів; на застосовуваних поживних середовищах виростає тільки частина повітряної мікрофлори. До того ж цей метод абсолютно непридатний при дослідженні бактеріальної забрудненості атмосферного повітря.
Більш досконалими методами є аспіраційні, засновані на примусовому осадженні мікроорганізмів з повітря на поверхню щільного живильного середовища або в уловлює рідина (м’ясо-пептонний бульйон, буферний розчин, ізотонічний розчин хлориду натрію та ін). У практиці санітарної служби при аспіраційному взятті проб використовуються апарат кротова, бактеріоуловітель речменского, прилад для відбору проб повітря (пов-1), пробовідбірник аерозольний бактеріологічний (паб-1), бактеріально-вірусний електропреципітатор (бвеп-1), прилад кіктенко, прилади андерсена, дьяконова, мб і ін.для дослідження атмосфери можуть бути використані і мембранні фільтри № 4, через які повітря просмоктується за допомогою апарату зейтца. Велика різноманітність приладів свідчить про відсутність універсального апарату і про більшу чи меншу ступінь їх недосконалості.
Прилад кротова. В даний час цей прилад широко застосовується при дослідженні повітря закритих приміщень і є в лабораторіях сес.
Принцип роботи апарату кротова заснований на тому, що повітря, що просмоктується через клиноподібну щілину в кришці апарату, вдаряється об поверхню живильного середовища, при цьому частинки пилу і аерозолю прилипають до середовища, а разом з ними і мікроорганізми, що знаходяться в повітрі. Чашку петрі з тонким шаром середовища зміцнюють на обертовому столику апарату, що забезпечує рівномірний розподіл бактерій на її поверхні. Працює апарат від електромережі. Після відбору проби з певною експозицією чашку виймають, закривають кришкою і поміщають на 48 год в термостат. Зазвичай відбір проб проводять зі швидкістю 20-25 л/хв протягом 5 хв.
Таким чином, визначається флора в 100-125 л повітря. При виявленні санітарно-показових мікроорганізмів обсяг досліджуваного повітря збільшують до 250 л.
Приймач перед забором проби повітря заповнюється 3-5 мл уловлює рідини (водою, м’ясопептонним бульйоном, ізотонічним розчином хлориду натрію).
Прилад речменського працює за принципом пульверизатора: при проходженні повітря через вузький отвір воронки рідина з приймача через капіляр у вигляді крапельок піднімається в циліндр. Краплі рідини ще більше дробляться, вдаряючись об скляну лопаточку і стінки судини, створюючи хмарка з дрібних крапельок, на яких і адсорбуються знаходяться в повітрі мікроорганізми. Насичені бактеріями краплі рідини стікають в приймач, а потім знову диспергуються, що забезпечує максимальне уловлювання бактерій з повітря. При роботі прилад поміщають під кутом 15-25°, що забезпечує стікання уловлює рідини в приймач. Швидкість відбору проб повітря через апарат річменського — 10-20 л/хв.після закінчення роботи рідину з приймача забирають стерильною піпеткою і засівають (по 0,2 мл) на поверхню щільних поживних середовищ. Перевагою бактеріоуловлювача річменського є висока ефективність уловлювання бактеріальних аерозолів. Недоліки приладу полягають в труднощі його виготовлення, нестандартності одержуваних апаратів, їх великий крихкості і порівняно низької продуктивності.
Великою перевагою є серійний випуск цього приладу (що дало можливість оснастити ним лабораторії сес), його портативність, більш висока продуктивність (20-25 л/хв). Колба приладу, в яку поміщається вловлює рідина, виготовляється з термостійкого плексигласу, капіляр з нержавіючої сталі. У колбу вмонтований пульверизатор, що викликає диспергування уловлює рідини при просмоктуванні повітря. Такий пристрій дає можливість легко очищати і стерилізувати колбу з диспергуючим пристроєм простим кип’ятінням протягом 30 хв (автоклавування неприпустимо, так як воно викликає деформацію циліндра).
Перед забором проб повітря в колбу вносять 5-10 мл уловлює рідини (найчастіше м’ясопептонний бульйон) і встановлюють її під кутом 10°, що забезпечує природне стікання рідини після диспергування. Повітря, проходячи через колбу і пульверизатор, викликає утворення дрібних крапельок уловлює рідини, на яких осідають мікроорганізми. Прилад пов-1 застосовується для дослідження повітря закритих приміщень на загальну мікробну обсіменіння, для виявлення патогенних бактерій (наприклад, мікобактерій туберкульозу) і респіраторних вірусів в повітрі лікарняних палат.
Пробовідбірник аерозольний бактеріологічний (паб-1). Механізм дії паб — 1 заснований на принципі електростатичного осадження частинок аерозолю (а отже, і мікроорганізмів) з повітря при проходженні його через прилад, в якому ці частинки отримують електричний заряд і осідають на електродах з протилежним знаком. На електродах для уловлювання аерозолів поміщають в горизонтальному положенні металеві піддони з твердими середовищами в чашках петрі або рідким живильним середовищем (15-20 мл). Прилад переносний з великою продуктивністю 150-250 л/хв, тобто за 1 год можна відібрати 5-6 м 3 повітря. Його рекомендують застосовувати для дослідження великих обсягів повітря при виявленні умовно-патогенних і патогенних мікроорганізмів, наприклад, при виявленні в повітрі палат лікарень збудників внутрішньолікарняних інфекцій (pseudomonas aeruginosa. Staph, aureus та ін.), визначенні сальмонел і ешерихій в атмосферному повітрі в місцях дощування при зрошенні землеробських полів стічними водами.
Бактеріально-вірусний електропреципітатор (бвеп-1)
Прилад заснований на аспіраційно-іонізаційному принципі дії. Бвеп — 1 складається з осадительной камери, в яку вмонтовані електроди: негативний у вигляді привідної трубки, через яку надходить повітря (і частинки аерозолю відповідно заряджаютьсяНегативно), і позитивний, на якому осідають бактерії.
Прилад мб. Цей прилад служить не тільки для визначення загальної мікробної обсіменіння, але і для відбору проб повітря з аерозольними частинками різних розмірів. Прилад мб побудований за принципом «сита» і являє собою циліндр, розділений на 6 горизонтальних смуг, на кожну з яких поміщають чашки петрі з мпа. Повітря просмоктується, починаючи з верхнього ступеня, в пластині якої отвори найбільші, і чим нижче ступінь, тим менше розміром отвору (через останні проходять тільки тонкодисперсні фракції повітряного аерозолю). Прилад розрахований на уловлювання частинок аерозолю розміром більше 1 мкм при швидкості відбору повітря 30 л/хв. Для уловлювання ще більш дрібних частинок аерозолю можна додавати додатково фільтр з фільтруючого матеріалу афа.
При використанні будь-якого з перерахованих приладів одержувані результати є приблизними, проте вони дають більш правильну оцінку обсіменіння повітря в порівнянні з седиментаційним методом. Оскільки і відбір і санітарно-мікробіологічні дослідження повітря не регламентовані гост, то можна використовувати будь-який прилад для оцінки бактеріальної забрудненості повітря. У багатьох випадках відбір проб суміщений з етапом посіву.
Для зниження чисельності мікроорганізмів в повітрі закритих приміщень застосовують такі засоби:
А) хімічні-обробка озоном, двоокисом азоту, розпорошення молочної кислоти,
Б) механічні-пропускання повітря через спеціальні фільтри,
В) фізичні — ультрафіолетове опромінення.
Визначення загальної чисельності сапрофітних бактерій
Загальна бактеріальна обсіменіння повітря або мікробне число — це сумарна кількість мікроорганізмів, що містяться в 1 м 3 повітря. Для визначення загальної кількості бактерій в повітрі закритих приміщень забирають дві проби (об’ємом по 100 л кожна) на чашки петрі з мпа за допомогою будь-якого приладу (найчастіше апарату кротова), або седиментаційним методом, розставляючи чашки з живильним середовищем за принципом конверта. Чашки з посівом поміщають в термостат на добу, а потім на 48 год залишають при кімнатній температурі. Експозиція чашок з посівами на світлі дає можливість підрахувати окремо кількість пігментних колоній (жовтих, білих, рожевих, чорних, помаранчевих та ін.), кількість спороутворюючих бацил, грибів і актиноміцетів.
Підраховують кількість колоній на обох чашках, обчислюють середнє арифметичне і роблять перерахунок на кількість мікроорганізмів в 1 м 3 повітря. Бацили утворюють колонії, як правило, великі, круглі, з нерівними краями, сухі, зморшкуваті. Колонії грибів з пухнастим нальотом (місог і aspergillus) і щільні — зеленуваті або сіруваті (penicillium). Актиноміцети утворюють білуваті колонії, врослі в агар. Кількість кожної групи колоній (пігментних, безпігментних, цвілі, бацил, актиноміцетів) виражають у відсотках по відношенню до загального числа.
При визначенні мікробного числа методом седиментації по коху підраховуються колонії, що виросли на мпа в чашках петрі, і розрахунок ведеться по b. Л.омелянскому. Якщо дотримуватися цієї методики, на чашку площею 100 см 2 за 5 хв осідає така кількість мікробів, яке міститься в 10 л повітря.
Визначення стафілококів
Стафілококи є одним з найбільш поширених мікроорганізмів в повітрі закритих приміщень, що обумовлюється значною стійкістю їх до різних факторів навколишнього середовища. Виявлення патогенних стафілококів в повітрі закритих приміщень має санітарно-показове значення і свідчить про епідемічне неблагополуччя. Відбір проб повітря проводиться за допомогою апарату кротова в кількості 250 л на 2-3 чашки з молочно-желточно-сольовим агаром (або молочно — сольовим, желточно-сольовим) і на чашку з кров’яним агаром. Чашки інкубують при температурі 37°с протягом 48 ч.вивчають культуральні ознаки всіх видів колоній, з підозрілих готують мазки і фарбують по граму.
Крім якісної характеристики окремих колоній, підраховують кількість виросли колоній стафілококів в 1 м 3 повітря.
Визначення стрептококів
Стрептококи також є санітарно-показовими мікроорганізмами повітря, в який вони потрапляють від хворих на скарлатину, тонзиліти, ангіну і носіїв стрептококів. Відбір проб повітря при дослідженні на наявність а — і р-гемолітичних стрептококів виробляють за допомогою апарату кротова на чашки з кров’яним агаром, середовищами гарро і туржецького. Забирають 200-250 л повітря, чашки з посівами витримують в термостаті 18-24 год і потім ще 48 год при кімнатній температурі (після попереднього перегляду та обліку). Ідентифікацію проводять за загальноприйнятою методикою.
Визначення патогенних мікроорганізмів у повітрі
Зважаючи на малу концентрацію патогенних мікроорганізмів у повітрі закритих приміщень, їх виділення є досить важким завданням.
При розшифровці внутрішньолікарняних інфекцій визначають в повітрі присутність стафілококів, стрептококів, синьогнійної палички, сальмонел, протеїв і ін.відбір проб повітря виробляють за допомогою паб-1 в обсязі не менше 1000 л. Посів виробляють на відповідні елективні середовища. Якщо використовується рідке середовище як уловлює рідина, то пробірку з рідиною поміщають в термостат на добу для підрощування (отримання накопичувальної культури), а потім висівають на елективне середовище.
При дослідженні повітря на наявність мікобактерій туберкульозу відбір проб виробляють за допомогою приладу пов-1 в обсязі 250-500 л повітря. Як уловлює рідини беруть середу школьниковой, яку потім обробляють 3% розчином сірчаної кислоти (для придушення супутньої мікрофлори) і центрифугують. Осад засівають в пробірки на одну з яєчних середовищ, частіше середу левенштейна-іенсена. Інкубують при 37°с до 3 міс. Відсутність зростання протягом 3 міс дає можливість видати негативну відповідь. Пробірки перший раз переглядають через 3 тижні, потім кожні 10 днів. Виділену культуру ідентифікують, визначають її вірулентність (зараженням морських свинок — біопроба) і при необхідності визначають стійкість до лікарських препаратів.
При визначенні в повітрі корінебактерій дифтерії для посіву повітря використовують чашки з середовищем клауберга.
В останні роки визначають в атмосферному повітрі в районах дощування землеробських полів, при зрошенні їх стічними водами, сальмонели в разі появи захворювання серед персоналу станцій зрошення або населення. Відбір проб виробляють за допомогою апарату кротова на чашки з вісмут-сульфітним агаром. Досліджують не менше 200 л повітря. Виділена культура ідентифікується за звичайною схемою визначення сальмонел.
У зв’язку з розвитком мікробіологічної промисловості виникла необхідність дослідження повітря з метою виявлення грибів-продуцентів при виробництві антибіотиків, ферментних препаратів, при виготовленні кормових дріжджів та ін.для дослідження повітря на цвілеві гриби роду candida відбір проб виробляють за допомогою апарату кротова в обсязі від 100 до 1000 л на чашки з середовищем чапека, суслоагаром (для виявлення цвілевих грибів) і з метабісульфіт-натрій — агаром (мбс-агар) з додаванням антибіотиків (для дріжджоподібних грибів роду candida). Чашки інкубують в термостаті при температурі 26-27°с протягом 3-4 діб (для цвілевих грибів) і при 35-37°с протягом 2-3 діб (для грибів — продуцентів і дріжджоподібних роду candida). Ідентифікація проводиться з урахуванням особливостей плодоносних гіф і характеру міцелію. Вважають, що концентрація дріжджоподібних грибів в кількості 500-600 клітин в 1 м 3 повітря робочого приміщення є граничною, перевищення її веде до розвитку алергічних реакцій у робітників.
Серед факторів навколишнього середовища, що впливають на життя людини, повітря займає провідне місце. Наука, що вивчає мікрофлору повітря, називається аеромікробіологією.
Повітря не є сприятливим середовищем для розвитку мікроорганізмів, так як не містить поживних речовин і знаходиться в постійному русі. Тому більшість мікроорганізмів швидко зникають з повітря. Однак деякі з них більш стійкі, наприклад туберкульозна паличка, спори клостридій, грибів та інші, можуть тривалий час зберігатися в повітрі.
У повітрі міст мікроорганізмів більше, ніж у повітрі лісів і полів.
Кількість мікроорганізмів у повітрі з висотою зменшується. Наприклад, на висоті 500 м над москвою в 1 м 3 повітря виявляють 2-3 бактерії, а на висоті 1000 м — вдвічі менше.
Кількість мікроорганізмів в приміщеннях зазвичай більше, ніж в повітрі відкритих місць.
Гост не нормує методи проведення дослідження повітря.Раніше велика увага приділялася визначенню гемолітичних стрептококів як показників забруднення повітря закритих приміщень мікрофлорою, що знаходиться в носоглотці людини. В даний час більше уваги приділяють безпосередньому виявленню в повітрі патогенних і умовно-патогенних мікроорганізмів.
Санітарно-бактеріологічне дослідження повітря проводять в плановому порядку: в лікарнях, операційних, дитячих установах та ін.
При санітарно-бактеріологічному дослідженні визначають:
1. Загальна кількість бактерій в 1 м 3 повітря.
2. Наявність патогенних і умовно-патогенних мікроорганізмів в 1 м 3 повітря.
Виявлення мікроорганізмів в повітрі проводиться за допомогою спеціальних приладів і спеціальних середовищ (діагностичних і диференційно-діагностичних).
Зміст
Методи відбору проб повітря
Існують два основних способи відбору проб повітря для дослідження: 1) седиментаційний — заснований на механічному осіданні мікроорганізмів; 2) аспіраційний — заснований на активному просмоктуванні повітря (цей метод дає можливість визначити не тільки якісне, але і кількісний вміст бактерій).
Седиментаційний метод
Чашки петрі з живильним середовищем (мпа) встановлюють у відкритому вигляді горизонтально, на різному рівні від підлоги. Метод заснований на механічному осіданні бактерій на поверхню агару в чашках петрі. Чашки з середовищем експонують від 10 до 20 хв, залежно від передбачуваного забруднення повітря. Для виявлення патогенної флори використовують елективні середовища. Експозиція в цих випадках подовжується до 2-3 ч. Після експозиції чашки закривають, доставляють в лабораторію і ставлять в термостат на 24 год при температурі 37° с. На наступний день вивчають виросли колонії. Метод цей використовують в основному в закритих приміщеннях.
(аспіраційний метод )
Бактериоуловитель речменского. Перед роботою прилад заповнюють стерильною содою. Дія приладу засноване на протягуванні через нього повітря за допомогою аспіратора. При цьому відбувається розпорошення знаходиться в приладі рідини. Після закінчення просмоктування рідина, через яку був пропущений повітря, засівають по 0,1-0,2 мл на мпа в чашках петрі. При необхідності використовувати елективні середовища посівну дозу збільшують (0,3-0,5 мл). Отримана в приймачі рідина може бути використана для зараження тварин (наприклад, при дослідженнях, що проводяться для виявлення вірусів, рикетсій і т.д.).
Прилад дьяконова також заснований на уловлюванні бактерій в рідині, через яку пропущений повітря.
Прилад паб-1 призначений для бактеріологічного дослідження великих обсягів повітря протягом короткого проміжку часу. Отримання проб повітря виробляють зі швидкістю 125-150 л/хв. Велика швидкість відбору проб повітря в цьому приладі і можливість посіву його на різні поживні середовища має значення для виявлення патогенних і умовно-патогенних бактерій (наприклад, синьогнійної палички в хірургічних відділеннях та ін.).
Апарат кротова. Дія заснована на принципі удару струменя повітря на середу в чашках петрі. Апарат складається з трьох частин: вузла для відбору проб повітря, ротаметра, електричної частини живильного механізму.
Досліджуване повітря за допомогою відцентрового вентилятора, що обертається зі швидкістю 4000-5000 об/хв, засмоктується в щілину приладу і вдаряється об поверхню відкритої чашки петрі з середовищем. Вміщені в повітрі мікроорганізми осідають на живильний агар. Для рівномірного розподілу мікроорганізмів по всій поверхні столик з знаходиться на ньому чашкою обертається. З приладу повітря виводиться через повітропровідну трубку, яка з’єднана з ротаметром, що показує швидкість протягування повітря через прилад.
Недоліком приладу кротова є те, що він потребує електроенергії, тому не у всіх умовах може бути використаний.
Перший день дослідження
Відібрані проби поміщають в термостат при 37° с на 18-24 ч.
Другий день дослідження
Чашку виймають з термостата і виробляють підрахунок колоній. Бактеріальне забруднення повітря виражається загальним числом мікробів в 1 м 3 його.
Розрахунок. Наприклад, за 10 хв пропущено 125 л повітря, на поверхні виросло 100 колоній.
Для визначення золотистого стафілокока паркан виробляють на желточно-сольовий агар. Чашки з посівами інкубують в термостаті при 37° с протягом 24 год і 24 год витримують при кімнатній температурі для виявлення пігменту. Колонії, підозрілі на s. Aureus, підлягають подальшій ідентифікації (див.главу 14).
У дитячих установах повітря перевіряють на наявність сальмонел. Для цього повітря засівають в чашку з середовищем вісмут-сульфітний агар.
Виявлення патогенних бактерій і вірусів в повітрі закритих приміщень проводять за епідеміологічними показаннями. Для виявлення збудників туберкульозу користуються приладом пов, в якості уловлює використовується середовище школьниковой.
Контрольні питання
1. Чи є повітря сприятливим середовищем для розвитку мікроорганізмів?
2. В яких установах проводять планове дослідження мікрофлори повітря?
3. Розкажіть пристрій апарату кротова.
Задача
За 10 хв було пропущено 250 л повітря. Виросло 150 колоній. Розрахуйте кількість колоній в 1 м повітря.
Завдання
Візьміть 4 чашки петрі з середовищем мпа, відкрийте їх і встановіть на різному рівні від підлоги. Через 20 хв закрийте чашки і поставте в термостат. На наступний день підрахуйте кількість виросли колоній, визначте ступінь забруднення повітря.
Велика група приладів і пристроїв призначається для концентрування мікроорганізмів в пробах з об’єктів зовнішнього середовища (вода, повітря), а також в пробах патологічного матеріалу від хворих.
Як відомо, об’єкти зовнішнього середовища можуть бути джерелом масових заражень людини і тварин, у разі забруднення їх патогенними мікроорганізмами. Для судження про наявність в об’єктах зовнішнього середовища патогенних мікроорганізмів, найбільш надійним критерієм є їх пряме виявлення. Однак використовувані в мікробіологічній практиці методи не завжди дозволяють робити це. Патогенні мікроорганізми важко виявити в об’єктах зовнішнього середовища, так як їх набагато менше, ніж сапрофітів. Тому в силу антагоністичних дій на поживних середовищах зростання патогенної флори часто пригнічується зростанням сапрофітів. Першочерговим завданням при дослідженні такого об’єкта зовнішнього середовища, як повітря, є концентрація зважених в ньому мікроорганізмів в невеликій кількості рідини (живильного середовища).
Одним з провідних показників бактеріальної обсіменіння об’єктів зовнішнього середовища є показник мікробного числа. Ці дані санітарної мікробіології реєструються підрахунком колоній, що виросли на чашках петрі, з подальшим перерахунком.
Значна кількість робіт присвячено методам забору проб повітря. Запропоновано велику кількість всіляких приладів, що вловлюють бактеріальні аерозолі.
Одним з перших приладів для дослідження аеромікрофлори, який був впроваджений в серійне виробництво в нашій країні, був прилад кротова . Незважаючи на порівняно велику кількість часу з початку його серійного випуску (п’ятдесяті роки), прилад не втратив своєї значущості при дослідженні санітарно-бактеріологічного стану повітря закритих приміщень і до сьогоднішнього дня широко використовується в практиці санітарно-бактеріологічних лабораторій.
Прилад для бактеріологічного аналізу повітря (прилад кротова) (рис. 58) являє собою циліндр, що закривається кришкою, під якою є столик для установки чашки петрі з щільним живильним середовищем. Усередині циліндра знаходиться електричний мотор, що обертає столик з чашкою і турбінку, засмоктує повітря всередину приладу через щілину, що знаходиться в кришці. Кількість повітря, що просмоктується в хвилину, визначається по поплавковому витратоміра і регулюється за допомогою вентиля. Прилад живиться від мережі змінного струму напругою 220 в. Габарити приладу в футлярі — 229x200x280 мм.маса — 8 кг.
Рис. 58. Прилад для бактеріологічного аналізу повітря.
1-вентиль ротаметра, 2 — ротаметр; 3 — накидні замки; 4 — диск обертається; 5 — кришка; 6 — диск; 7 — клиноподібна щілина; 8 — корпус; 9-підстава.
Підготовка приладу до роботи зводиться до відбору стандартних чашок петрі діаметром 100 мм і висотою 20 мм і завчасного заповнення їх живильним середовищем в кількості 15 мл.розлив і охолодження поживних середовищ проводиться на строго горизонтальній поверхні, підсушування в звичайних умовах.
Іншим приладом аналогічного призначення є пробовідбірник повітря пов-1(рис.59).
Рис. 59. Пробовідбірник повітря пов-1
Забір проб повітря проводиться в рідку живильне середовище, що дозволяє застосовувати специфічні елективні середовища і проводити спеціальні (спрямовані) бактеріологічні дослідження.
Технічна характеристика приладу пов-1
Продуктивність………… 20 л / хв
Живлення від мережі змінного струму….. 127/220 в
Споживана потужність……….не більше 18 в а
Габарити приладу……………………..170x255x285 мм
» укладання……………………..170x270x350 »
Маса (з укладанням)……………………..не більше 15 кг
Аспіратор для відбору проб повітря, модель 822 , що випускається об’єднанням «красногвардієць» призначений для аналізу містяться в повітрі домішок. На передній панелі приладу (рис. 60) розташовані: колодка для підключення приладу до мережі 1, тумблер для включення і виключення апарату 2, гніздо запобіжника 3, розвантажувальний клапан, що оберігає від перевантаження електродвигун при відборі проб повітря з малими швидкостями 4, ротаметри (конусні скляні трубки з поплавцями) для визначення швидкості проходження повітря 5, ручки вентилів ротаметрів для регулювання швидкості відбору проб 6, гвинти кріплення панелі до кожуха приладу 7, штуцери для приєднання гумових трубок з фільтрами 8 і клема для заземлення приладу 9.
Рис. 60. Аспіратор для відбору проб повітря. Пояснення в тексті.
На рис. 61 показаний загальний вигляд аспіратора з утримувачем фільтрів.
Відбір проб проводиться при просмоктуванні повітря через спеціальні фільтри з певною швидкістю. Повітря, проходячи через фільтри, залишає на них містяться в ньому домішки. Знаючи швидкість проходження повітря і час проходження, можна визначити обсяг повітря, що пройшов через фільтр. Визначивши кількість домішок на фільтрі, можна розрахувати кількість домішок в одиниці об’єму повітря.
Аспіратор для забору проб повітря випускає французька фірма «baudard» . Аспіратор являє собою герметичний апарат з пристосуванням для зміцнення дрібнопористих фільтрів, які легко можуть бути вилучені після просмоктування через аспіратор заданого обсягу повітря і, в залежності від мети дослідження, вивчатися або бактеріологічно (інкубування фільтра з наявними на ньому мікроорганізмами на поживних середовищах), або мікроскопічно (визначення природи частинок, затриманих фільтром, їх підрахунок і т.п.).
Використовувані дрібнопористі фільтри можуть бути або паперовими, або виготовленими зі скловолокна. Діаметр фільтрів становить 110 мм.
Вентилятор центріфужного принципу дії має дві швидкості і розрахований на живлення від електромережі напругою 220 в; потужність мотора — 50 вт; продуктивність аспіратора — від 360 до 1000 л/хв в залежності від опору використовуваного мелкопористого фільтра.
При дослідженні води та інших об’єктів зовнішнього середовища (грунт), а також біологічних рідин людини і тварин (мокрота, ексудати і транссудати) на наявність патогенної флори, як і при дослідженні повітря, необхідна попередня концентрація мікроорганізмів в невеликому обсязі живильного середовища, яка в подальшому піддається бактеріологічному дослідженню (мікроскопія, посів, постановка біохімічних і серологічних реакцій і т.д.).
Рис. 61. Аспіратор з утримувачем фільтрів.
Однак прогрес в області методів концентрування мікроорганізмів з об’єктів зовнішнього середовища невеликий, і здебільшого доводиться обмежуватися старими методиками, що представляють різні способи накопичення:
— осадженням механічними способами-фільтрація, центрифугування, випаровування води;
— осадженням мікробів фізико-хімічними методами за допомогою різних коагулянтів;
— концентруванням мікробів методом флотації;
— осадженням мікробів специфічними аглютинуючими сироватками;
— застосуванням комбінованих методів концентрування мікроорганізмів, що полягають у поєднанні методів осадження з подальшим висівом на поживні середовища або зараженням сприйнятливої лабораторної тварини.
Нові методи концентрування мікроорганізмів засновані на застосуванні деяких фізичних принципів . Одним з таких фізичних принципів є електрофорез. Застосування цього методу забезпечує рух мікробної клітини до одного з електродів, розташованих в рідкому середовищі, під впливом прикладеної до електродів зовнішньої електрорушійної сили (ерс). Цей принцип покладено в основу приладу ефм — 1 (рис. 62). Прилад дозволяє концентрувати мікробні клітини, що мають позитивний або негативний поверхневий заряд в малому обсязі ізольованої рідини (0,01-0,02 мл).
Рис. 62. Прилад для електрофорезу мікобактерій ефм-1.
Крім досліджень води, прилад може бути використаний для бактеріологічних досліджень водних суспензій харчових продуктів, різних змивів і т. П. Прилад також може бути використаний і для виявлення мікроорганізмів в різних матеріалах, отриманих від хворих, зокрема для виявлення мікобактерій туберкульозу в таких матеріалах, як спинномозкова рідина, промивні води бронхів і шлунка, всілякі пунктати, сеча. У мазках, приготованих з суспензії мікобактерій туберкульозу в фізіологічному розчині і підданих електрофоретичної концентрації, кількість мікробних клітин збільшується в 10-15 разів в порівнянні з мазками з нативного матеріалу.
Прилад забезпечений комплектом приладдя, куди входять 20 небитких кювет ємністю по 12 мл, електроди, піпетки. Прилад живиться від мережі змінного струму напругою 220 в± ±10%, 50 гц. Споживана потужність-не більше 20 вт. Габарити-405x165x205 мм. Маса приладу з комплектом приладдя — 6 кг.
Принцип роботи приладу. У спеціальні кювети, з комплекту до приладу, наливають по 10 мл досліджуваного матеріалу. Над кожною кюветою за допомогою затиску-тримача зміцнюють піпетку, в яку поміщений графітовий електрод. Частина досліджуваної рідини піднімається на 4-5 мм по капіляру піпетки і стосується електрода. Залежно від мети дослідження встановлюють полярність прикладеної ерс. Електрофорез рекомендується проводити протягом 1-3 год.
Після виключення струму рідина з капіляра за допомогою гумового балончика видавлюють в краплю сироватки (нормальна кінська або кроляча сироватка в розведенні 1:10), попередньо нанесену на поверхню предметного скла, і ретельно перемішують запаяної пастерівської піпеткою, препарат висушують, фіксують над полум’ям пальника і фарбують по граму, циль — нільсену або іншим способом.
Щоб виключити можливість діагностичних помилок, всі маніпуляції проводять з ретельно обробленими кюветами, піпетками і предметними стеклами. Графітові електроди після кожного дослідження необхідно міняти.
Розчини фарб і кислоти повинні бути ретельно перевірені бактеріологічно.
Для збільшення точності підрахунку виросли мікробних колоній київським заводом медичного обладнання випускається прилад для рахунку колоній бактерій . Для підрахунку колоній електропером на дно чашки наносяться точки в місці » знаходження кожної колонії, при цьому контакти електропера замикаються і надходить до лічильника електричний імпульс виробляє відлік. Зовнішній вигляд приладу наведено на рис. 63.
Рис. 63. Прилад для рахунку колоній.
Для підрахунку числа колоній на закритій чашці використовується олівець або ручка, якими ставлять позначки на зворотному боці чашки, що виключає можливість повторного обліку однієї і тієї ж колонії.
Універсальний лічильник для підрахунку колоній на живильному середовищі «бактронік» укомплектований електронним наконечником для підрахунку числа колоній на відкритих чашках. При контакті з будь-агаризованою середовищем наконечник включає електромагнітний рахунковий механізм і залишає слід на поверхні середовища.
Такий пристрій усуває електророзряди, які мають місце при використанні інших систем.
При підрахунку числа колоній на чашках з рідкісним зростанням можна використовувати кнопку на панелі приладу, а якщо необхідно — дистанційний кнопковий вимикач, що полегшує роботу.
Фірма «millipore» випускає спеціальну валізу-укладку для мікробіологічних досліджень . Валіза, що є по суті портативною лабораторією (мал. 64), забезпечує всіма необхідними матеріалами та обладнанням для досліджень бактеріального забруднення води, виявлення мікроорганізмів в повітрі і в грунті, контроль температури і росту бактерій, виявлення дріжджових грибів в навколишньому середовищі, утворення газу дріжджами, визначення ефективності дезінфектантів і т.д.
Рис. 64. Валіза-укладання для мікробіологічних досліджень.
Для визначення якості харчових продуктів випускається люміноскоп лпк-1 . З його допомогою можна визначати видову приналежністьМ’яса, ранню псування свинини і свинячого жиру, співвідношення складових частин фаршу, експертизу харчових масел, жирів, меду та інших продуктів (рис. 65).
У приладі використаний принцип візуального люмінесцентного аналізу. Під дією ультрафіолетових променів харчові продукти в залежності від їх властивості і якості починають світитися різним кольором, а світлофільтри виділяють відповідні ділянки спектру. При роботі з приладом не потрібно затемнення приміщення, дослідник захищений від впливу ультрафіолетових променів.
Режим роботи приладу повторний. Час роботи-1 год, пауза — 25 хв.на дослідження продукту витрачається не більше 1 хв. Живлення приладу від мережі змінного струму — 220 в±10%. Споживана потужність — не більше 350 вт. Габаритні розміри-366x185x240 мм. Маса-6 кг.
Рис. 65. Прилад для визначення якості продуктів лпк-1.
Пошук лекцій
Санітарно-мікробіологічне дослідження повітря можна розділити на 4 етапи:
1) відбір проб;
2) обробка, транспортування, зберігання проб, отримання концентрату мікроорганізмів (якщо необхідно);
3) бактеріологічний посів, культивування мікроорганізмів;
4) ідентифікація виділеної культури.
Відбір проб:
Правильне взяття проб гарантує точність дослідження. У закритих приміщеннях точки відбору проб встановлюються з розрахунку на кожні 20 м2 площі — одна проба повітря, за типом конверта: 4 точки по кутах кімнати (на відстані 0,5 м від стін) і 5-я точка — в центрі. Проби повітря забираються на висоті 1,6-1,8 м від підлоги — на рівні дихання в житлових приміщеннях. Проби необхідно відбирати вдень (в період активної діяльності людини), після вологого прибирання і провітрювання приміщення. Атмосферне повітря досліджують в житловій зоні на рівні 0,5-2 м від землі поблизу джерел забруднення, а також в зелених зонах (парки, сади і т.д.) для оцінки їх впливу на мікрофлору повітря.
Слід звернути увагу на те, що при відборі проб повітря в багатьох випадках відбувається посів його на живильне середовище.
Седиментаційний-найбільш старий метод, широко поширений завдяки простоті і доступності, проте є неточним. Метод запропонований р. Кохом і полягає в здатності мікроорганізмів під дією сили тяжіння і під впливом руху повітря (разом з частинками пилу і крапельками аерозолю) осідати на поверхню живильного середовища у відкриті чашки петрі. Чашки встановлюються в точках відбору на горизонтальній поверхні.
прилади та пристрої для санітарної мікробіології
При визначенні загальної мікробної обсіменіння чашки з мясопептонним агаром залишають відкритими на 5-10 хв або довше в залежності від ступеня передбачуваного бактеріального забруднення. Для виявлення санітарно-показових мікробів застосовують середовище гарро або туржецького (для виявлення стрептококів), молочно-сольовий або желточно-сольовий агар (для визначення стафілококів), суслоагар або середу сабуро (для виявлення дріжджів і грибів). При визначенні санітарно-показових мікроорганізмів чашки залишають відкритими протягом 40-60 хв.
Після закінчення експозиції всі чашки закривають, поміщають в термостат на добу для культивування при температурі, оптимальній для розвитку виділяється мікроорганізму, потім (якщо цього вимагають дослідження) на 48 год залишають при кімнатній температурі для утворення пігменту пигментообразующими мікроорганізмами.
Седиментаційний метод має ряд недоліків: на поверхню середовища осідають тільки грубодисперсні фракції аерозолю; нерідко колонії утворюються не з одиничної клітини, а зі скупчення мікробів; на застосовуваних поживних середовищах виростає тільки частина повітряної мікрофлори. До того ж цей метод абсолютно непридатний при дослідженні бактеріальної забрудненості атмосферного повітря.
Більш досконалими методами являютсяаспіраціонние , засновані на примусовому осадженні мікроорганізмів з повітря на поверхню щільної живильного середовища або в уловлюючу рідину (м’ясо-пептонний бульйон, буферний розчин, ізотонічний розчин хлориду натрію і ін.). У практиці санітарної служби при аспіраційному взятті проб використовуються апарат кротова, бактеріоуловітель речменского, прилад для відбору проб повітря (пов-1), пробовідбірник аерозольний бактеріологічний (паб-1),бактеріально-вірусний електропреципітатор (бвеп-1), прилад кіктенко, прилади андерсена, дьяконова, мб і ін.для дослідження атмосфери можуть бути використані і мембранні фільтри № 4, через які повітря просмоктується за допомогою апарату зейтца. Велика різноманітність приладів свідчить про відсутність універсального апарату і про більшу чи меншу ступінь їх недосконалості.
Прилад кротова. в даний час цей прилад широко застосовується при дослідженні повітря закритих приміщень і є в лабораторіях
Апарат кротова
Принцип роботи апарату кротова (рис. 22) заснований на тому, що повітря, що просмоктується через клиноподібну щілину в кришці апарату, вдаряється об поверхню живильного середовища, при цьому частинки пилу і аерозолю прилипають до середовища, а разом з ними і мікроорганізми, що знаходяться в повітрі.
Бактеріально-вірусний електропреципітатор (бвеп-1). прилад заснований на аспіраційно-іонізаційному принципі дії. Бвеп — 1 складається з осадительной камери, в яку вмонтовані електроди: негативний у вигляді привідної трубки, через яку надходить повітря (і частинки аерозолю відповідно заряджаються негативно), і позитивний, на якому осідають бактерії.
Прилад мб. цей прилад служить не тільки для визначення загальної мікробної обсіменіння, але і для відбору проб повітря з аерозольними частинками різних розмірів. Прилад мб побудований за принципом «сита» і являє собою циліндр, розділений на 6 горизонтальних смуг, на кожну з яких поміщають чашки петрі з мпа. Повітря просмоктується, починаючи з верхнього ступеня, в пластині якої отвори найбільші, і чим нижче ступінь, тим менше розміром отвору (через останні проходять тільки тонкодисперсні фракції повітряного аерозолю). Прилад розрахований на уловлювання частинок аерозолю розміром більше 1 мкм при швидкості відбору повітря 30 л/хв. Для уловлювання ще більш дрібних частинок аерозолю можна додавати додатково фільтр з фільтруючого матеріалу афа.
При використанні будь-якого з перерахованих приладів одержувані результати є приблизними, проте вони дають більш правильну оцінку обсіменіння повітря в порівнянні з седиментаційним методом. Оскільки і відбір і санітарно-мікробіологічні дослідження повітря не регламентовані гост, то можна використовувати будь-який прилад для оцінки бактеріальної забрудненості повітря. У багатьох випадках відбір проб суміщений з етапом посіву.
Для зниження чисельності мікроорганізмів в повітрі закритих приміщень застосовують такі засоби: а) хімічні — обробка озоном, двоокисом азоту, розпорошення молочної кислоти, б) механічні — пропускання повітря через спеціальні фільтри, в) фізичні — ультрафіолетове опромінення.
©2015-2018 poisk-ru.ru
Всі права належати їх авторам. Даний сайт не претендує на авторства, а надає безкоштовне використання.
Порушення авторських прав та порушення персональних даних
тема. Аналіз мікрофлори повітря в приміщенні.
Мета роботи :
— набуття навичок і умінь у кількісному визначенні мікроорганізмів чашковим методом.
Завдання:
Вивчити кількісний метод визначення мікроорганізмів повітря;
— провести мікробіологічний посів з повітря різних приміщень седиментаційним методом;
— провести підрахунок колоній за правилом омелянського.
Сутність методу:
— спочатку роблять посів досліджуваного субстрату в чашці петрі з щільним живильним середовищем. Посіви термостатируют, і виросли колонії підраховують. Метод широко використовується для визначення мікроорганізмів у харчових продуктах, воді, повітрі.
Мікрофлора повітря
Мікробна забрудненість повітря підпорядковується законам аеробіології має непостійний і локальний характер. Влітку обсіменіння повітря в кілька разів вище, ніж взимку. Особливо сильно мікроорганізмами насичене атмосферне повітря над великими містами. Мікрофлора атмосферного повітря і мікрофлора повітря житлових приміщень різниться.
Мікрофлора атмосферного повітря . В атмосферному повітрі стафілококи і стрептококи виявляють лише в 3,7% проб, взятих в місцях великого скупчення людей. Серед мікроорганізмів домінують види, що мешкають в грунті. В атмосферному повітрі в основному зустрічають три групиМікроорганізм.
· пигментообразующие коки в сонячні дні складають до 70-80% всієї флори (пігмент захищає бактерії від інсоляції).
· грунтові спорові і гнильні мікроорганізми . Їх зміст різко збільшується в суху і вітряну погоду.
· цвілеві гриби і дріжджі . Їх вміст збільшується при підвищенні вологості повітря.
На відміну від повітря закритих приміщень , в атмосферному повітрі постійно відбуваються процеси самоочищення. Цей процес відбувається завдяки опадам, інсоляції, температурним впливам і іншим факторам. У свою чергу атмосферне повітря сам по собі-фактор очищення повітря житлових приміщень.
Мікрофлора повітря закритих приміщень більш одноманітна і відносно стабільна. Серед мікроорганізмів домінують мешканці носоглотки людини, в тому числі патогенні види, що потрапляють в повітря при кашлі, чханні або розмові.
методи бактеріологічного контролю повітря приміщень
Основне джерело забруднення повітря патогенними видами-бактеріоносії. Рівень мікробного забруднення залежить головним чином від щільності заселення, активності руху людей, санітарного стану приміщення, в тому числі пилової забрудненості, вентиляції, частоти провітрювання, способу прибирання, ступеня освітленості та інших умов. Так, регулярні провітрювання і вологе прибирання приміщень знижує обсіменіння повітря в 30 разів (в порівнянні з контрольними приміщеннями). Самоочищення повітря закритих приміщень не відбувається.
Ознаки колоній мікроорганізмів.
Важливі ознаки колоній — їх розміри і форма. Колонії можуть бути великими або дрібними.
Величина колоній, розміри колоній-ознака, що дозволяє розрізняти різні види, пологи і навіть типи бактерій. У більшості випадків колонії грампозитивних бактерій дрібніше колоній грамнегативних бактерій.
Колонії бактерій можуть бути плоскими, піднятими, опуклими, мати вдавлений або піднятий центр.
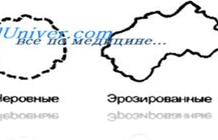
Інша важлива ознака — форма країв колоній . При вивченні форми колоній враховують характер її поверхні: матовий, блискучий, гладкий або шорсткий. Краї колоній можуть бути рівними, хвилястими, дольчатими (глибоко порізаними), зубчастими, ерозованими, торочкуватими і т. Д.
Визначення кількості мікроорганізмів
В повітрі приміщення.
Повітря несприятливе середовище для мікроорганізмів, так як в ньому немає поживних речовин і постійної оптимальної температури.
Санітарну оцінку повітря житлових і виробничих приміщень здійснюють за загальним мікробному числу (омч). У повітрі виробничих приміщень визначають омч в одиниці об’єму повітря за методом омелянського-седиментаційний метод . Метод заснований на здатності мікроорганізмів під впливом сили тяжіння осідати, падати вниз.
Правило омелянського:
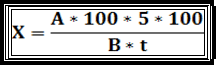
На підставі цього правила їм виведена формула для розрахунку кількості мікроорганізмів в 1 м3 повітря:
X-кількість мікроорганізмів в 1 м2 повітря
А-число колоній, що виросли на чашці петрі при аналізі
100 – число для перерахунку на 1 м3 з 10 дм3
5 – коефіцієнт часу омелянського
100 – площа чашки петрі омелянського (см2)
В – площа чашки петрі, взятої для аналізу (см2)
T –тривалість часу (хв), протягом якого була відкрита чашка (5 хв).
Хід роботи
1. Приготувати щільне живильне середовище для вирощування мікроорганізмів – мпа (м’ясо-пептонний агар): за схемою розчинити мпа в дистильованій воді (3,8 г сухого мпа + 100 мл дистильованої води), прокип’ятити 30 хв, злегка остудити і розлити в стерильні чашки петрі. Після застигання мпа на дні чашок, щільне середовище слід підсушити в сушильній шафі при температурі 450с протягом 10 хв (агарова пластинка повинна бути звернена вниз).
2. Провести посів мікроорганізмів з повітря різних приміщень навчального закладу: відкрити чашки петрі з середовищем в досліджуваному приміщенні на 5 хв, закрити і помістити в термостат (при 300с) на 72 години для визначення омч, для визначення дріжджів і цвілевих грибів – (при 250с) на 5-7 діб. Термостатування проводять перевертаючи чашки петрі кришками вниз.
3. Після термостатування виробляють підрахунок колоній, що виросли на чашках петрі, і роблять перерахунок на 1 м2 повітря згідно з правилом омелянського. Підрахунок колоній проводять за допомогою лічильника колоній. Чашки при підрахунку розміщують дном догори на темному тлі.
При підрахунку колоній дотримуються наступних правил:
— якщо на чашці зросла невелика кількість колоній (до 100), підраховують всі колонії;
— якщо колонії розподілені рівномірно і їх кількість близько 200-300, чашки ділять маркером на 6 секторів і вважають колонії в двох протилежних секторах, обчислюють середнє і множать на 6.
Висновки
Згідно з нормативними документами, повітря закритих приміщень вважають чистим при вмісті в 1 м3 до 2000 бактерій.
В повітрі харчових виробничих цехів повинно міститися не більше 100-500 бактерій в 1 м3 в залежності від характеру виробництва. У повітрі харчових підприємств нормується вміст збудників псування продуктів-цвілевих грибів і дріжджів.
Контрольні питання
1. Від яких факторів залежить мікрофлора повітря?
2. Як визначити ступінь забрудненості повітря мікроорганізмами?
3. Які форми мікроорганізмів найчастіше бувають патогенними?
Лабораторна робота №12
б. Методи забору проб повітря
1. Гравітаційний метод заснований на тому, що зважені в повітрі щільні частинки осідають під дією сили тяжіння. Для збору проб гравітаційним методом застосовують пробозаборник дарема (див. 3.1). У тримач приладу вставляють предметне скло, покрите гліцериновим гелем, який готують наступним чином: 5 г желатину, 40 мл води, 4 г фенолу змішують з 195 г гліцерину і нагрівають; під час нагрівання в гель вводять 2 мл розчину кальберія — 5 мл гліцерину, 10 мл 95% етилового спирту і 2 краплі насиченого водного розчину фуксину основного. Прилад залишають на повітрі на 24 ч.переносяться повітряним потоком частинки під дією сили тяжіння осідають на предметне скло. Склад і кількість частинок визначають під мікроскопом. Результати виражають у вигляді кількості частинок, що осіли на 1 см2 за 24 ч.цей метод простий і недорогий, але має наступні недоліки.
А. На результати дослідження впливають напрямок і швидкість вітру, вологість повітря і опади.
Б. За 24 год осідає невелика кількість частинок.
В.на скло осідають в основному великі частинки.
2. Об’ємометричні методи засновані на тому, що зважені в повітрі частинки затримуються на перешкоді, встановленому на шляху повітряного потоку.
А. Ротаційний пробозаборник. збирає поверхню, покрита спеціальною речовиною, обертається протягом певного часу із заданою швидкістю. Результат проби виражають у вигляді кількості частинок, що осіли на 1 см2 за 24 ч.цей метод дозволяє виключити вплив швидкості і напрямку вітру на результати дослідження. У пробозаборнику ротород (семплінг текнолоджіс інк., рис. 3.2) збирає поверхнею служать акрилові стрижні, покриті тонким шаром силіконової мастила. В інших приладах збирає поверхню обертається не постійно, а періодично, що дозволяє уникнути її переповнення, в перервах між обертаннями вона прикривається заслінками. Американська академія алергології та імунології в якості стандартних об’ємометричних пробозабірників рекомендує використовувати саме ці прилади.
Б. Аспіраційні пробозаборники пропускають повітря через мембранні фільтри з відомим діаметром пір, тому на збиральній поверхні осідають частинки заданого розміру. На цьому принципі заснована спорова пастка бурхарда (див. 3.3), що збирає поверхню якої переміщається зі швидкістю 2 мм/год, що дозволяє стежити за зміною концентрації частинок в повітрі протягом усього періоду спостереження. Оскільки прилад має флюгер, на результати проб не впливає напрямок вітру. Більш складний пробозабірник аккувол (див. 3.4) вловлює частинки менше 1 мкм в діаметрі.
Оцінка результатів
А. За допомогою гравітаційних методів в пробах повітря можна виявити тільки великі частинки (більше 20 мкм в діаметрі), наприклад пилок амброзії. Для наукових цілей використовуються більш точні об’ємометричні методи. Існують керівництва щодо визначення спор грибів і пилку. Таблиці, складені за результатами кількісного мікроскопічного дослідження проб повітря, дозволяють визначити сезонні піки концентрації пилку і спор грибів в різних штатах в ту чи іншу пору року (див.додаток vi). Між загостренням атопічного захворювання і середньою добовою концентрацієюАлергенів в повітрі, яка визначається за допомогою кількісного мікроскопічного дослідження, чіткого зв’язку немає. Це пояснюється тим, що при низькій середній добовій концентрації алергенів загострення атопічного захворювання може бути спровоковано короткочасним підвищенням їх концентрації. Крім того, кількісне мікроскопічне дослідження не завжди дозволяє точно судити про концентрацію повітряних алергенів.
Б. Для кількісного визначення алергенів за допомогою імунологічних методів використовуються мічені антитіла. Встановлено зв’язок між концентрацією алергенів, яка визначається імунологічними методами, і загостренням атопічного захворювання, особливо екзогенної бронхіальної астми. Однак таких досліджень мало, опубліковані лише дані по антигену e амброзії, алергенів комах і грибів роду alternaria. Імунологічні методи дослідження повітряних алергенів, які не визначаються мікроскопічно, наприклад частинок епідермісу тварин і комах, дуже точні. У ряді випадків ці дослідження дозволяють встановити причину алергії.
В.алергени пилку. Пилок складається з безлічі пилкових зерен, що містять чоловічі гамети і службовців для статевого розмноження насіннєвих рослин. У ентомофільних (запилюються комахами) рослин з яскравими і ароматними квітками пилок велика, клейка, поширюється, як правило, на незначні відстані, концентрація її в повітрі невелика. У анемофільних (вітрозапилюваних) рослин квітки маленькі, непомітні, без запаху, а пилок дрібний, нелипкий, з гладкою і рівною поверхнею. Причиною алергії зазвичай є саме пилок анемофільних рослин, тому що її концентрація в повітрі в період цвітіння набагато вище, ніж концентрація пилку ентомофільних рослин. Викид пилку у більшості анемофільних рослин відбувається рано вранці, проте її концентрація в повітрі зазвичай стає максимальною вдень або рано ввечері. Це обумовлено тим, що вдень посилюється циркуляція повітря. У суху погоду навіть під дією слабкого вітру пилок може поширюватися на великі відстані, тому навіть у великих містах концентрація пилку в повітрі може бути дуже високою. Хоча через кілька годин пилок втрачає життєздатність, її алергенні властивості зберігаються протягом тривалого часу. У додатку vi наведені флористична карта сша і канади і перелік квітучих рослин, поширених в різних флористичних районах.
1. Амброзія . Головною причиною алергічного рінокон’юнктівіта в сша служить пилок амброзії (ambrosia spp.)- представника сімейства складноцвітих. У північно-східній частині сша і басейні річки міссісіпі амброзія поширена особливо широко, оскільки родюча, культивована грунт цих районів ідеально підходить для її зростання. Виділяють два пилкових антигену амброзії-антиген e (amb ai) і антиген k (amb aii).
всі методи відбору проб повітря можна розділити на седиментаційні і аспіраційні.
Обидва добре вивчені. Антиген e-це поліпептид з молекулярною масою 37 800, антиген k — поліпептид з молекулярною масою 38 000. Антиген e становить всього 6% білкової фракції екстракту пилку, проте він в 200 разів активніше антигену k.
2. Зілля. пилок злаків важко розрізнити за морфологічними ознаками, тому при виявленні її в зразках повітря перш за все враховують, які злаки поширені в даній місцевості.
А. У південних районах сша і на південному узбережжі тихого океану широко поширений свинорой, на північному сході і в північній частині басейну річки міссісіпі-тонконіг, тимофіївка, їжака збірна і мітлиця біла (див.додаток vi).
Б. Алергія до пилку трав, в тому числі злаків, розвивається лише в період їх цвітіння, який залежить від кліматичних умов, тому для кожного району характерні свої сезонні піки захворюваності. Так, в північних районах пік захворюваності припадає на весну і літо, в південних районах частота загострень протягом року майже не змінюється. На великій висоті над рівнем моря, наприклад в районі скелястих гір, і в північних штатах сша (вісконсін, мічиган, мен) концентрація пилку невелика.
В.у сша пилок злаків займає друге місце після пилку амброзії по частоті і тяжкості викликаються нею алергічних реакцій. В інших країнах вона є найбільш значущим повітряним алергеном.
Р пилок тонконога, тимофіївки, мітлиці білої і їжаки збірної має подібні антигени і викликає перехресні алергічні реакції. Пилок свинороя істотно відрізняється за антигенним складом від пилку інших трав і не викликає перехресних реакцій.
3. Деревина. Алергію викликає, як правило, пилок анемофільних дерев. Пилок ентомофільних дерев, наприклад плодових і декоративних, викликає алергію вкрай рідко. Не викликає алергію і пилок анемофільних дерев, покрита щільною зовнішньою оболонкою.
А. Пилок різних дерев має чіткі морфологічні ознаки. Крім того, дерева розрізняються за тривалістю, інтенсивності і сезону цвітіння.
Б. Оскільки пилок дерев різних родів має дуже мало перехресних антигенів і в межах одного флористичного району зазвичай переважають дерева певного роду, в ньому спостерігається алергія до пилку дерев тільки одного роду.
В.оскільки період цвітіння у дерев зазвичай нетривалий, загострення алергії до їх пилку також короткочасні.
Р цвітіння листяних дерев починається до, під час або незабаром після появи листя. У районах з помірним кліматом сезон цвітіння закінчується пізньою весною, коли дерева повністю покриваються листям. У більш теплих районах сезон цвітіння триває довше (див.додаток vi).
1. Будова грибів. За морфологічними ознаками все гриби діляться на дріжджові і міцеліальні. Дріжджові гриби складаються з окремих клітин, які розмножуються безстатевим шляхом — поділом або брунькуванням. Міцеліальні гриби відносяться до багатоклітинних організмів і являють собою мережу розгалужених ниток — гіф, які можуть утворювати суперечки. Спори грибів розносяться водою, вітром і тваринами. Цвіль-це розташовані на поверхні поживного субстрату органи розмноження різних видів грибів. Цвіль складається з переплетених гіф і спор і являє собою аморфну масу, яка може мати різне забарвлення, форму і консистенцію. Цвілеві гриби — не таксономічне, а традиційна назва грибів, що утворюють цвіль.
2. Класифікація грибів заснована на способі розмноження. Гриби розмножуються шляхом фрагментації гіф і спорами, які утворюються безстатевим (просте ділення клітин) і статевим (злиття двох клітин з утворенням зиготи) шляхом. У життєвому циклі більшості грибів чергуються стадії безстатевого-недосконала стадія — і статевого-досконала стадія-розмноження. За сучасною класифікацією гриби діляться на 4 класи: ascomycetes, basidiomycetes, zygomycetes і oomycetes. Гриби пологів alternaria, penicillium і aspergillus раніше відносилися до класуdeuteromycetes (недосконалі гриби, що розмножуються тільки безстатевим шляхом), а за сучасною класифікацією входять в підклас hyphomycetes класаascomycetes(див.табл. 3.1). Саме ці гриби найчастіше викликають алергію. Оскільки класифікація hyphomycetes заснована тільки на морфології суперечка і не відображає інших ознак, різні гриби, що входять в цей підклас, значно відрізняються один від одного за антигенним складом.
3. Поширеність грибів. завдяки величезній різноманітності і винятковій здатності до виживання в різних кліматичних умовах гриби поширені повсюдно. Вони зберігають життєздатність навіть при низькій температурі. Їх мало лише в посушливих і високогірних районах, де недостатньо вологи і кисню. Гриби, що мешкають в будинках, часто служать причиною цілорічних алергічних захворювань. У житлових приміщеннях грибів особливо багато в старій меблевій оббивці, кімнатних зволожувачах повітря, на фіранках для душу, сантехніці, в сміттєвих баках, харчових відходах, сирих підвалах.
4. Контакт з грибами. Алергічні захворювання, викликані грибами, протікають з періодичними загостреннями, зумовленими підвищенням концентрації грибів в повітрі, наприклад після відвідування лісу або ферми, заготівлі сіна або зерна, збору опалого листя, вологим, теплим літом і восени після листопаду (див . Табла. 3.1). Представники деяких професій-хлібороби, садівники, робітники паперових фабрик — особливо часто контактують з грибами. Так зване новорічне загострення алергії до грибів обумовлено тим, що їх дуже багато на ялинках, а різкий запах хвої і пил з ялинкових іграшок сприяють загостренню захворювання. Способи боротьби з грибами викладені в гл.4, п. Iii.д.
5. Лабораторне дослідження. Кращий спосіб профілактики алергії до грибів-постійний контроль за їх вмістом вНавколишньому середовищу і боротьба з ними. Лабораторні дослідження необхідні для: 1) визначення грибів, що послужили причиною алергічного захворювання, наприклад екзогенного алергічного альвеоліту, 2) оцінки ефективності боротьби з грибами, 3) визначення видів грибів, поширених в даному районі.
Кількісне визначення присутніх в повітрі грибів засноване на мікроскопічному дослідженні проб, отриманих за допомогою об’ємометричних методів, і культур, отриманих при посіві цих проб. Для культивування грибів зазвичай застосовують середовище сабуро і агар з картопляним крохмалем або кукурудзяним борошном. Визначення грибів вимагає часу, спеціального обладнання та професійних навичок. Необхідно враховувати, що певні умови культивування, наприклад температура, вологість повітря, атмосферний тиск, сприяють зростанню грибів, які не мають клінічного значення. Цвілеві гриби, які особливо часто викликають алергію, перераховані в табл. 3.1 і додатку vi.
Д.епідермальні алергени. найчастіше алергію викликають епідерміс собак і кішок, а також використовуються для набивання меблів, подушок і перин шерсть (найчастіше козяча або овеча) і перо (наприклад, качине). Оброблені шерсть і шкури рідше викликають алергію, оскільки найбільш сильні алергени водорозчинні і видаляються під час обробки. Багато епідермальні алергени виявляються також в слині і сечі тварин. Епідермальні алергени дуже активні, і навіть нетривалий контакт з ними здатний викликати сильну алергічну реакцію. До найбільш активних епідермальним алергенів відносяться антигени епідермісу кішок. Частинки епідермісу кішок дуже дрібні (менше 2,5 мкм), повільно осідають і накопичуються в повітрі, тому навіть короткочасне перебування в приміщенні, де живе кішка, може спровокувати бурхливу алергічну реакцію. Оскільки це епідермальні алергени, алергію викликають як довгошерсті, так короткошерсті і нелінійні тварини. У будинках і квартирах поширенню епідермальних алергенів сприяють центральні системи повітряного опалення. Прибирання приміщень і миття тварин — тимчасові і малоефективні протиалергічні заходи. Епідермальні алергени можуть служити причиною професійних алергічних захворювань. У людей, які живуть в багатоквартирних і містяться в поганому стані будинках, часто виникають алергічні реакції на епідерміс і сечу гризунів.
Попередня 45678910111213141516171819слідуюча
Переглянути ще:
аспіратори повітря і пробовідбірні пристрої
Проби атмосферного повітря відбирають в судини обмеженої ємності, як правило, аспіраційним способом. Цей спосіб заснований на добуванні визначається речовини поглинальним розчином або твердими сорбентами з великою поглинаючою поверхнею (селікагель, алюмогель, активоване вугілля та ін.). Широко поширене також використання фільтруючих матеріалів з тонких волокон (ацетилцелюлози, поліакрилонітрилу, поліакрилату та ін.). Як і у всіх аналітичних дослідженнях, правильний відбір проб має вирішальне значення. Результати самого точного і ретельно виконаного аналізу втрачають будь-який сенс в разі неправильної підготовки до відбору проби і невірного її виконання. Зазвичай місце для відбору проб повітря слід вибирати так, щоб в безпосередній близькості від нього не було будь-яких дерев або стін будівель. Не можна також проводити відбір проб під час дощу або снігопаду. При відборі проб необхідно також враховувати агрегатний стан і властивості визначається забруднювача. Найбільш часто при аналізі повітря безпосередньо в процесі відбору проб виробляються поділ і концентрування компонентів повітря, що підлягають визначенню. Залежно від передбачуваного рівня вмісту визначається забруднювача повітря відбір проб може здійснюватися із застосуванням концентрування або без нього. В останньому випадку в якості пробовідбірних ємностей використовують скляні шприци, газові піпетки, мішки з полімерних плівок, гумові камери та ін. Повітря простягають через сорбенти або поглинальний розчин з певною швидкістю за певний проміжок часу. При відборі проб необхідне отримання статистично усередненого зразка. Статистично усереднений зразок повітря можна отримати, прокачуючи великі обсяги його через спеціальні фільтри або рідкі поглиначі і потім вимиваючи абсорбований забруднювач спеціаль ними розчинами. Іноді фільтри-поглиначі можуть озоляться або аналізуватися безпосередньо (наприклад нейтронно-активаційним методом). Підвищення концентрацій забруднювачів повітря за допомогою звичайних адсорбентів з метою їх подальшої десорбції та кількісного визначення є підготовчим етапом до газохроматографічного аналізу. При використанні газорідинної хроматографії для визначення низьких концентрацій речовин, що містяться в повітрі, застосовують два основні методи попереднього концентрування. Згідно з першим, через концентратор пропускають аналізований повітря в такій кількості, щоб сорбент був повністю насичений обумовленим речовиною. Найчастіше в цьому випадку використовують охолодження (рідкий азот, сухий лід з ацетоном). Цей метод найбільш придатний для аналізу малолетучих речовин. За другим методом аналізований повітря пропускають через концентратор в такій кількості, щоб настала рівновага між сорбентом і газовою фазою. Цей метод придатний головним чином для визначення легколетучих речовин в повітрі робочої зони. Концентрація аналізованих речовин в атмосферному повітрі (с, мг / м 3) обчислюється за формулою с = m / v, де m-маса речовини, знайдена в аналізованій пробі, мкг; v – об’єм досліджуваної проби повітря, приведений до нормальних умов (t = 0 ос, p0 = 101080 па), л. V = 273 p vt / , де р – атмосферний тиск при відборі проби, па; t – температура повітря в місці відбору проби, ос; vt – об’єм проби повітря при температурі t, л.
Аспіраційний метод має ряд недоліків: по-перше, він трудомісткий і, по-друге, вимагає тривалого часу (до 30 хв) аспірації, що може призвести до усереднення концентрації токсичних речовин, в той час як концентрація речовин в повітрі змінюється досить швидко.
7)методи визначення забруднень атмосферного повітря
Екологічний моніторинг атмосферного повітря включає в себе вивчення джерел забруднення, дослідження хімічних і фотохімічних перетворень забруднюючих речовин, виявлення найбільш токсичних речовин, вивчення поширення забруднюючих речовин в атмосферному повітрі з повітряними потоками, визначення концентрацій забруднюючих речовин і прогноз зміни екосистем під впливом забруднень повітря. Аналіз повітря, що містить забруднення, досить складний, так як необхідно, з одного боку, проаналізувати складну за складом багатокомпонентну суміш, а з іншого боку, зробити вибіркове визначення шкідливих речовин при їх концентрації в повітрі на рівні гдк і нижче. Крім того, визначення не повинно бути тривалим (по госту тривалість відбору проб не повинна перевищувати 30 хв). Підготовка проби залежить від методу аналізу забруднень в атмосфері. Залежно від природи забруднюючої речовини і його концентрації в повітрі використовуються методи газової і газорідинної хроматографії, нейтронно-активаційний, атомно-абсорбційний, полярографічний, фотометричний і спектрофотометричний та інші методи. Визначення забруднень в атмосфері включає наступні операції: відбір проб повітря і концентрування мікропримісей шкідливих речовин; підготовка проби до аналізу; аналіз мікропримісей, обробка результатів аналізу і прогноз зміни стану навколишнього середовища. Проби атмосферного повітря відбирають в судини обмеженої ємності, як правило, аспіраційним способом. Цей спосіб заснований на добуванні визначається речовини поглинальним розчином або твердими сорбентами з великою поглинаючою поверхнею (селікагель, алюмогель, активоване вугілля та ін.). Широко поширене також використання фільтруючих матеріалів з тонких волокон (ацетилцелюлози, поліакрилонітрилу, поліакрилату та ін.). Як і у всіх аналітичних дослідженнях, правильний відбір проб має вирішальне значення. Результати самого точного і ретельно виконаного аналізу втрачають будь-який сенс в разі неправильної підготовки до відбору проби і невірного її виконання. Зазвичай місце для відбору проб повітря слід вибирати так, щоб в безпосередній близькості від нього не було будь-яких дерев або стін будівель. Не можна також проводити відбір проб під час дощу або снігопаду. При відборі проб необхідно також враховувати агрегатний стан і властивості визначаєтьсяЗабруднювач. Найбільш часто при аналізі повітря безпосередньо в процесі відбору проб виробляються поділ і концентрування компонентів повітря, що підлягають визначенню. Залежно від передбачуваного рівня вмісту визначається забруднювача повітря відбір проб може здійснюватися із застосуванням концентрування або без нього. В останньому випадку в якості пробовідбірних ємностей використовують скляні шприци, газові піпетки, мішки з полімерних плівок, гумові камери та ін. Повітря простягають через сорбенти або поглинальний розчин з певною швидкістю за певний проміжок часу. При відборі проб необхідне отримання статистично усередненого зразка. Статистично усереднений зразок повітря можна отримати, прокачуючи великі обсяги його через спеціальні фільтри або рідкі поглиначі і потім вимиваючи абсорбований забруднювач спеціаль ними розчинами. Іноді фільтри-поглиначі можуть озоляться або аналізуватися безпосередньо (наприклад нейтронно-активаційним методом). Підвищення концентрацій забруднювачів повітря за допомогою звичайних адсорбентів з метою їх подальшої десорбції та кількісного визначення є підготовчим етапом до газохроматографічного аналізу. При використанні газорідинної хроматографії для визначення низьких концентрацій речовин, що містяться в повітрі, застосовують два основні методи попереднього концентрування. Згідно з першим, через концентратор пропускають аналізований повітря в такій кількості, щоб сорбент був повністю насичений обумовленим речовиною. Найчастіше в цьому випадку використовують охолодження (рідкий азот, сухий лід з ацетоном). Цей метод найбільш придатний для аналізу малолетучих речовин. За другим методом аналізований повітря пропускають через концентратор в такій кількості, щоб настала рівновага між сорбентом і газовою фазою. Цей метод придатний головним чином для визначення легколетучих речовин в повітрі робочої зони. Концентрація аналізованих речовин в атмосферному повітрі (с, мг / м 3) обчислюється за формулою с = m / v, де m-маса речовини, знайдена в аналізованій пробі, мкг; v-обсяг досліджуваної проби повітря, приведений до нормальних умов (t = 0 ос, p0 = 101080 па), л. V = 273 p vt / , де р – атмосферний тиск при відборі проби, па; t – температура повітря в місці відбору проби, ос; vt – обсяг проби повітря при температурі t, л.
санітарно-бактеріологічне дослідження повітря-ф. К. Черкес
Серед факторів навколишнього середовища, що впливають на життя людини, повітря займає провідне місце. Наука, що вивчає мікрофлору повітря, називається аеромікробіологією.
Повітря не є сприятливим середовищем для розвитку мікроорганізмів, так як не містить поживних речовин і знаходиться в постійному русі. Тому більшість мікроорганізмів швидко зникають з повітря. Однак деякі з них більш стійкі, наприклад туберкульозна паличка, спори клостридій, грибів та інші, можуть тривалий час зберігатися в повітрі.
У повітрі міст мікроорганізмів більше, ніж у повітрі лісів і полів.
Кількість мікроорганізмів у повітрі з висотою зменшується. Наприклад, на висоті 500 м над москвою в 1 м3 повітря виявляють 2-3 бактерії, а на висоті 1000 м — вдвічі менше.
Кількість мікроорганізмів в приміщеннях зазвичай більше, ніж в повітрі відкритих місць.
Гост не нормує методи проведення дослідження повітря. Раніше велика увага приділялася визначенню гемолітичних стрептококів як показників забруднення повітря закритих приміщень мікрофлорою, що знаходиться в носоглотці людини. В даний час більше уваги приділяють безпосередньому виявленню в повітрі патогенних і умовно-патогенних мікроорганізмів.
Санітарно-бактеріологічне дослідження повітря проводять в плановому порядку: в лікарнях, операційних, дитячих установах та ін.
При санітарно-бактеріологічному дослідженні визначають:
1. Загальна кількість бактерій в 1 м3 повітря.
2. Наявність патогенних і умовно-патогенних мікроорганізмів в 1 м3 повітря.
Виявлення мікроорганізмів в повітрі проводиться за допомогою спеціальних приладів і спеціальних середовищ (діагностичних і диференційно-діагностичних).
методи відбору проб повітря
Існують два основних способи відбору проб повітря для дослідження: 1) седиментаційний — заснований на механічному осіданні мікроорганізмів; 2) аспіраційний — заснований на активному просмоктуванні повітря (цей метод дає можливість визначити не тільки якісне, але і кількісний вміст бактерій).
відбір проб повітря
Седиментаційний метод
Чашки петрі з живильним середовищем (мпа) встановлюють у відкритому вигляді горизонтально, на різному рівні від підлоги. Метод заснований на механічному осіданні бактерій на поверхню агару в чашках петрі. Чашки з середовищем експонують від 10 до 20 хв, залежно від передбачуваного забруднення повітря. Для виявлення патогенної флори використовують елективні середовища. Експозиція в цих випадках подовжується до 2-3 ч.після експозиції чашки закривають, доставляють в лабораторію і ставлять в термостат на 24 год при температурі 37° с. На наступний день вивчають виросли колонії. Метод цей використовують в основному в закритих приміщеннях.
Бактериоуловитель речменского. Перед роботою прилад заповнюють стерильною содою. Дія приладу засноване на протягуванні через нього повітря за допомогою аспіратора. При цьому відбувається розпорошення знаходиться в приладі рідини. Після закінчення просмоктування рідина, через яку був пропущений повітря, засівають по 0,1-0,2 мл на мпа в чашках петрі. При необхідності використовувати елективні середовища посівну дозу збільшують (0,3-0,5 мл). Отримана в приймачі рідина може бути використана для зараження тварин (наприклад, при дослідженнях, що проводяться для виявлення вірусів, рикетсій і т.д.).
Прилад дьяконова також заснований на уловлюванні бактерій в рідині, через яку пропущений повітря.
Прилад паб-1 призначений для бактеріологічного дослідження великих обсягів повітря протягом короткого проміжку часу. Отримання проб повітря виробляють зі швидкістю 125-150 л/хв. Велика швидкість відбору проб повітря в цьому приладі і можливість посіву його на різні поживні середовища має значення для виявлення патогенних і умовно-патогенних бактерій (наприклад, синьогнійної палички в хірургічних відділеннях та ін.).
Апарат кротова. Дія заснована на принципі удару струменя повітря на середу в чашках петрі. Апарат складається з трьох частин: вузла для відбору проб повітря, ротаметра, електричної частини живильного механізму.
Досліджуване повітря за допомогою відцентрового вентилятора, що обертається зі швидкістю 4000-5000 об/хв, засмоктується в щілину приладу і вдаряється об поверхню відкритої чашки петрі з середовищем. Вміщені в повітрі мікроорганізми осідають на живильний агар. Для рівномірного розподілу мікроорганізмів по всій поверхні столик з знаходиться на ньому чашкою обертається. З приладу повітря виводиться через повітропровідну трубку, яка з’єднана з ротаметром, що показує швидкість протягування повітря через прилад.
Недоліком приладу кротова є те, що він потребує електроенергії, тому не у всіх умовах може бути використаний.
Перший день дослідження
Відібрані проби поміщають в термостат при 37° с на 18-24 ч.
Другий день дослідження
Чашку виймають з термостата і виробляють підрахунок колоній. Бактеріальне забруднення повітря виражається загальним числом мікробів в 1 м3 його.
Розрахунок. Наприклад, за 10 хв пропущено 125 л повітря, на поверхні виросло 100 колоній.
Для визначення золотистого стафілокока паркан виробляють на желточно-сольовий агар. Чашки з посівами інкубують в термостаті при 37° с протягом 24 год і 24 год витримують при кімнатній температурі для виявлення пігменту. Колонії, підозрілі на s. Aureus, підлягають подальшій ідентифікації (див.главу 14).
У дитячих установах повітря перевіряють на наявність сальмонел. Для цього повітря засівають в чашку з середовищем вісмут-сульфітний агар.
Виявлення патогенних бактерій і вірусів в повітрі закритих приміщень проводять за епідеміологічними показаннями. Для виявлення збудників туберкульозу користуються приладом пов, в якості уловлює використовується середовище школьниковой.
контрольні питання
1. Чи є повітря сприятливим середовищем для розвитку мікроорганізмів?
2. В яких установах проводять планове дослідження мікрофлори повітря?
3.Розкажіть пристрій апарату кротова.
Задача
За 10 хв було пропущено 250 л повітря. Виросло 150 колоній. Розрахуйте кількість колоній в 1 м повітря.
Завдання
Візьміть 4 чашки петрі з середовищем мпа, відкрийте їх і встановіть на різному рівні від підлоги. Через 20 хв закрийте чашки і поставте в термостат. На наступний день підрахуйте кількість виросли колоній, визначте ступінь забруднення повітря.
Тема 3. Гігієнічна оцінка мікробного забруднення повітря приміщень
Тема 3. Гігієнічна оцінка мікробного забруднення повітря приміщень
Мета заняття:вивчення методів визначення та оцінки бактеріальної забрудненості повітряного середовища приміщень.
При підготовці до заняття студенти повинні опрацювати наступні питання теорії.
1. Епідеміологічне значення повітряного середовища. Джерела мікробного забруднення повітря приміщення.
2. Характеристика бактеріального складу атмосферного повітря і повітря приміщень. Фактори, що сприяють зниженню мікробного забруднення повітря приміщень.
3. Значення бактеріального забруднення повітря при виготовленні лікарських препаратів.
4. Методи дослідження та оцінки ступеня бактеріального забруднення повітря закритих приміщень.
Після освоєння теми студент повинен знати:
Методику проведення відбору проб повітря, їх аналізу, визначення ступеня бактеріального забруднення повітря аптечних приміщень;
Розрахунок необхідної потужності і кількості бактерицидних опромінювачів при знезараженні повітря і поверхонь приміщень аптек;
Вміти:
Оцінити результати досліджень повітря на відповідність гігієнічним нормативам;
Оцінити умови праці персоналу аптек при дії біологічних чинників за даними санітарно-гігієнічного обстеження і лабораторних досліджень;
Використовувати основні нормативні документи та інформаційні джерела довідкового характеру для організації контролю за рівнем мікробного забруднення в повітрі аптечних приміщень та розробки профілактичних заходів щодо запобігання та зниження рівня забруднення повітря аптечних приміщень.
навчальний матеріал для виконання завдання
Повітря може забруднюватися аеропланктоном, тобто бактеріями, вірусами, спорами цвілевих грибів, дріжджовими грибами, цистами найпростіших, спорами мохів і ін.основним джерелом забруднення повітря служить грунт. Потрапляють в атмосферне повітря мікроорганізми порівняно швидко гинуть внаслідок висихання, дії ультрафіолетових променів сонця і відсутності поживного матеріалу. Однак в приземному шарі атмосфери і в повітрі погано вентильованих закритих приміщень завжди виявляються сапрофітні і іноді і патогенні мікроорганізми.
При виробництві лікарських препаратів на основі біологічного синтезу працюючі можуть піддаватися впливу аерозолю живих клітин мікробів-продуцентів, продуктів метаболізму мікроорганізмів і пилоподібних кінцевих продуктів, часто містять більше 50% білка (наприклад, на заводах, що виготовляють білково-вітамінні концентрати). на етапах власне отримання і виділення антибіотиків, а також на заключних етапах (сушка, фасовка, упаковка) працюючі можуть піддавати — ся впливу пилу антибіотиків. Контроль за вмістом в повітрі шкідливих речовин біологічної природи (антибіотики, ферменти, вітаміни та ін.) проводять аналогічним способом: як це прийнято для хімічних речовин відповідно до вимог методичних вказівок «мікробіологічний моніторинг вироб — водственной середовища» (му 4.2.734-99) і додатки 10 керівництва 2.2.755-99 «методика контролю вмісту мікроорганізмів в повітрі робочої зони».
В приміщеннях аптек бактеріальне забруднення повітря, відбувається за рахунок виділень відвідувачів і працівників аптек, має велике значення, так як є причиною можливого інфікування персоналу збудниками різних інфекційних захворювань, а також небезпеку влучення мікроорганізмів у ліки. Потрапила в лікарські препарати мікрофлора призводить до зміни їх фізико-хімічних властивостей, зниження терапевтичної активності, зменшення термінів зберігання, може стати причиною розвитку захворювань і ускладнень у хворого. Найбільш інтенсивне бактеріальне забруднення повітря відзначається в торговому залі, мийної та допоміжних приміщеннях.
Біологічними компонентами пилу приміщень є мікрофлора (бактерії, віруси і гриби) верхніх дихальних шляхів, шкіри, мікроскопічні кліщі, спори цвілевих грибів. Санітарнопоказательнимі мікроорганізмами в повітрі закритих приміщень є стафілококи, зеленящие стрептококи, а показниками прямої епідемічної небезпеки — гемолітичні стрептококи. Незважаючи на порівняно короткий термін перебування в повітрі, мікроби створюють епідемічну небезпеку. Джерелами мікробного забруднення повітря в стаціонарах всіх типів є медичний персонал і хворі, які страждають стертими (безсимптомними) формами інфекційних хвороб, а також носії полірезистентних до антибіотиків штамів патогенних і умовно патогенних мікроорганізмів.
Нормативів вмісту мікроорганізмів в повітрі житлових приміщень немає. Нормативи бактеріальної чистоти виробничих приміщень (лікарень, аптек) розроблені в залежності від їх функціонального призначення з урахуванням інтенсивності бактеріальної обсіменіння і ризику виникнення внутрішньолікарняних інфекцій. Відповідно до нормативних документів (санпін 2.1.3.1375-03) бактеріальну чистоту повітря оцінюють диференційовано за загальною кількістю мікроорганізмів в 1 м 3 повітря, а в приміщеннях класів а, б, і в необхідно контролювати наявність колоній staphylococcus aureus, які не повинні визначатися в 1 м 3 повітря, і цвілевих і дріжджових грибів, які не повинні визначатися в 1 дм 3 повітря.
Одним з ефективних методів знезараження повітря є використання бактерицидної дії ультрафіолетових променів з довжиною хвилі 254-257 нм. З метою санації аптечних і лікувальних приміщень в даний час застосовуються бактерицидні увіолевие лампи був-15, був-30, що представляють собою газорозрядні ртутні лампи низького тиску. Лампи зроблені у вигляді трубок різної довжини з увіолевого скла і наповнені газовою сумішшю, що складається з парів ртуті і аргону. В кінці трубок впаяні вольфрамові електроди. При пропущенні струму через трубку виникає газовий розряд, в результаті якого відбувається світіння. Увіолеве скло лампи пропускає уф-промені, що вбивають мікроби, забезпечуючи при цьому високий знезаражувальний ефект.
В аптеках застосовуються стельові бактерицидні опромінювачі (пбо) і настінні бактерицидні опромінювачі (нбо). Пбо мають
Дві екрановані лампи був-15 і дві відкриті лампи був-30. При використанні пбо, особливо при включенні неекранованих бактерицидних ламп, знезаражувальний ефект настає за рахунок дії прямого потоку променів. Нбо має дві бактерицидні лампи: одна, екранована лампа, опромінює верхню зону і інша — неекранована — нижню зону. Надійний бактерицидний ефект досягається при роботі бактерицидних опромінювачів протягом двох годин при потужності ламп 3 вт на 1 м 3 .
При тривалій роботі бактерицидних ламп в повітрі приміщень можуть накопичуватися озон і окис азоту в кількості, що перевищують гдк цих речовин, тому використання ультрафіолетового опромінення вимагає дотримання правил техніки безпеки. У присутності працюючих рекомендується застосовувати екрановані бактерицидні лампи потужністю 1 вт на1 м 3, а у відсутності людей використовуються бактерицидні лампи відкритого типу (не) потужністю 3 вт на 1 м 3 . пбо і нбо є стаціонарними бактерицидними установками. В даний час в лікувально-профілактичних установах і аптеках застосовуються пересувні бактерицидні опромінювачі, що дає можливість більш ефективно проводити знезараження повітря.
Визначення кількості бактерій здійснюється седиментаційним або аспіраційним методами.
седиментаційний метод заснований на природному осадженні бактерій з повітря на чашку петрі з живильним середовищем і подальшим витримуванням в термостаті протягом двох діб при температурі 37 ?з і підрахунком колоній, що виросли за цей час на всій площі чашки.
Принцип аспіраційного методу-аспірація певного обсягу повітря з висіванням містяться в ньому бактерій на поверхню живильного середовища із застосуванням щілинного приладу кротова (рис. 10) або за допомогою мікробіологічного імпактора повітря «флора-100».
Прилад кротова являє собою циліндр зі знімною кришкою, в якому знаходиться електромотор з відцентровим вентиляційним ром. Принцип роботи приладу заснований на інерційному осадженні частинок аерозолю на поверхню живильного середовища. Досліджуване повітря всмоктується зі швидкістю 20-25 л/хв через клиноподібну
Щілину в кришці приладу, вдаряється об поверхню щільного живильного середовища, і мікроби затримуються на її вологій поверхні. Для рівномірного посіву мікробів чашка петрі з живильною сре — дой поміщається на підставку, що обертається зі швидкістю 1 оборот в 1 с. Швидкість аспірації повітря регулюється по мікроманометру (реометру) приладу. Загальний обсяг проби при значному забрудненні повітря повинен становити 40 — 50 л, при незначному — більше 100 л. Тривалість аспірації 2-5 хв. Після інкубування відібраних проб при температурі 37 ?с протягом 1-2 діб в залежності від виділяються мікроорганізмів проводиться підрахунок виросли колоній. З огляду на обсяг взятої проби повітря, обчислюється кількість мікробів в 1 м 3 повітря.
Рис. 10. прилад кротова для бактеріологічного дослідження повітря
Імпактор «флора-100», сучасна модель приладу для уловлювання бактерій з повітря, працює в автоматичному режимі і перевершує прилад кротова за технічними характеристиками.
Визначення кількості мікроорганізмів в повітрі служить одним з гігієнічних критеріїв його чистоти. Про ступінь бактеріального забруднення повітря судять за загальною кількістю бактерій, що містяться в 1 м 3 повітря. Крім того, оцінку повітря можна дати за змістом санітарно-показових мікроорганізмів (різних видів стрептококів і стафілококів) — звичайних мешканців слизових оболонок дихальних шляхів людини. Вміст мікроорганізмів в повітрі різне в різні сезони року. У холод-
Ний період повітря має менше мікробне забруднення, а влітку повітря більше забруднюється мікробами, що надходять в нього у великій кількості разом з частинками грунтового пилу. В якості орієнтовних показників оцінки бактеріального забруднення повітря в житлових приміщеннях використовуються запропоновані а. І. Шафіром наступні величини (табл. 9).
Таблиця 9. 14 оцінка чистоти повітря за бактеріологічними показниками повітря аптечних приміщень у різні періоди року
оцінка чистоти повітря
літній період (квітень-вересень)
зимовий період (жовтень-березень)
всього мікроорганізмів
гемолітичного стрептокока
всього мікроорганізмів
гемолітичного стрептокока
Чистий
<3500
<5000
Помірно забруднений
3500-5000
24-52
5000-7000
52-124
Забруднений
>5000
>7000
>124
лабораторна робота «визначення та оцінка мікробного забруднення повітря»
завдання студенту
1. Провести бактеріологічний посів повітря за допомогою приладу кротова.
2. Провести підрахунок колоній в чашці петрі, посів повітря на живильне середовище якої був зроблений за допомогою апарату кротова добу тому зі швидкістю 20 л/хв протягом 5 хв і яка знаходь — лась в термостаті при температурі 37 ?с протягом доби.
3. Визначити рівень бактеріального забруднення в приміщенні аптеки.
4. Дати гігієнічну оцінку ефективності роботи бактерицидних ламп за умовами ситуаційного завдання.
Методика роботи
визначення мікробного забруднення повітря
Отримавши одну з чашок петрі з виросли мікробними колоніями, ознайомитися з містяться в задачі відомостями про час,
Місце і умови відбору проби повітря (швидкість і час аспірації).
Для підрахунку числа колоній треба розділити поверхню чашки на 4 рівних стора, завдавши лінії розділу на скло кришки. Підрахувати загальне число колоній на поверхні j чашки і помножити на 4. Підрахунок можна здійснювати простим оком або через лупу. Число виросли колоній можна прийняти приблизно рівною кількості мікробних тіл в посіяному на чашку петрі обсязі повітря. Потім, враховуючи умови відбору проби, розрахувати загальну кількість мікроорганізмів в 1 м 3 повітря приміщення.
Оцінку ступеня мікробного забруднення повітря провести відповідно до градацій, наведених у табл. 9.
розрахунок необхідної потужності і кількості уф-опромінювачів в приміщенні
Необхідна потужність (n) бактерицидних ламп визначається за формулою:
N = e v,
Де: e-нормована величина питомої потужності ламп:
3 вт / м 3 — для ламп відкритого типу,
1 вт / м 3 — для ламп екранованого типу,
V — об’єм приміщення, м 3 .
Необхідна кількість бактерицидних ламп (к) визначається за формулою:
К = n / (потужність бактерицидної лампи).
Розвиток досліджень в області аеробіології показав, що в повітрі закритих приміщень поряд з великою кількістю сапрофітних мікроорганізмів можуть перебувати патогенні бактерії і віруси; менінгококи, патогенні стафілококи, збудники дифтерії, туберкульозу, кашлюку, віруси грипу, віспи, аденовіруси та ін.санітарно-бактеріологічні дослідження повітря проводять в плановому порядку в яслах і дитячих садах, лікарнях, операційних, аптеках, школах, кінотеатрах. Досліджують також атмосферне повітря.
При санітарно-бактеріологічному дослідженні повітря проводять:
1) визначення загальної бактеріальної обсіменіння повітря (загальне число бактерій в 1 м 3);
2) виявлення саиитарно-показових мікроорганізмів;
3) за епідемічними показаннями виділення вірусів і патогенних бактерій з повітря закритих приміщень;
4) при дослідженні атмосферного повітря додаткове визначення якісного складу мікрофлори з урахуванням наявності спороутворюючих аеробів і анаеробів, які служать показником забрудненості повітря мікроорганізмами грунту.
Методи відбору проб повітря для бактеріологічного дослідження поділяють на:
1) аспіраційні, засновані на активному просмоктуванні повітря за допомогою різних приладів;
2) седиментаційні, засновані на принципі механічного осідання мікробів.
Проби повітря беруть на рівні сидячого або стоїть людини, виділяючи одну точку взяття проб на кожні 20 м 2 площі.
Аспіраційні методи використовують при дослідженні повітря як закритих приміщень, так і атмосферного. Найбільш широке застосування в останні роки отримав апарат кротова (рис. 44), який дозволяє пропускати від 25 до 50 л повітря в хвилину. В апараті кротова повітря засмоктується крізь вузьку щілину кришки приладу і вдаряється об поверхню щільної живильного середовища в чашці петрі, яка повільно обертається на рухомому столику. Поверхня живильного середовища рівномірно обсіменяется мікроорганізмами.
Існують також інші прилади: пов-1, бактеріоуловітел речменского, дияконова, в яких повітря просмоктується за допомогою насосів, повітродувок, аспіраторів через матеріал, що затримує бактеріальний аерозоль. В якості такого матеріалу використовують стерильну воду, поживні середовища, стерильний ватний тампон, пінисті або порошкові фільтри з розчинних матеріалів. Обсяг просмоктується повітря вимірюють за допомогою газових годин. Після взяття проби 1 мл рідини засівають в чашку з м’ясо-пептонним агаром для визначення загального числа бактерій. Через 24 год інкубації в термостаті при 37°с підраховують число колоній і роблять перерахунок на 1 м 3 повітря. З метою визначення санітарно-показових мікроорганізмів і патогенних мікробів роблять посіви на різні елективні середовища.
Седиментаційний метод найстаріший (метод осідання коха). Його використовують тільки при дослідженні повітря закритих приміщень. Для цього чашки петрі з поживними середовищами при дослідженні загальної бактеріальної забрудненості повітря залишають відкритими в місцях відбору проб протягом 5-10 хв.після закінчення експозиції чашки заривають і поміщаю в термостат при 37°с на 24 год, а потім при кімнатній температурі витримує ще добу. Про ступінь забрудненості повітря судять за кількістю виросли колоній. Незважаючи на неточність, даний метод придатний для порівняльних оцінок чистоти повітря.
В даний час бактеріологічне дослідження повітря проводиться в основному в лікарнях згідно «інструкції з бактеріологічного контролю комплексу санітарно-гігієнічних заходів в лебечно-профілактичних установах: відділеннях хірургічного профілю, в палатах і відділеннях реанімації та інтенсивної терапії» (додаток до наказу № 720 від 31.07.1978 мз срср). Визначають загальну бактеріальну обсіменіння і наявність staph, aureus.
Для встановлення загальної бактеріальної обсіменіння повітря закритих приміщень, згідно з інструкцією, відбирають дві проби повітря за допомогою апарату кротова по 100 л кожна.
З метою дослідження повітря на наявність стафілокока беруть проби повітря на дві чашки з желточно-сольовим агаром або молочно-желточно-сольовим агаром, пропускаючи 250 л повітря.
Санітарно-бактеріологічне дослідження повітря має велике значення в хірургічних відділеннях лікарень, пологових будинках, де є небезпека виникнення внутрішньолікарняної інфекції. Виявлення staph, aureus в цих відділеннях є неприпустимим. Наростання кількості staph, aureus певних фаготипів слід розглядати як грізний провісник можливої появи госпітальної інфекції.
Виявлення вірусів і патогенних бактерій з повітря закритих приміщень проводять за епідеміологічними показаннями при оцінці ефективності знезараження повітря, при контролі санітарно-мікробіологічного змісту лікарняних установ і т. Д.
Для виявлення мікобактерій туберкульозу відбір проб виробляють за допомогою приладу пов-і, в якому в якості уловлює використовують середовище школьниковой. Досліджують 250-500 л повітря (див.мікробіологічна діагностика туберкульозу).
Еталоном чистоти атмосферного повітря вважають показник бактеріальної обсіменіння в зеленій зоні (зелена зона вднг—350 мікробів в 1 м 3). Приклад значного обсіменіння повітря-місця скупчення людей і транспорту. Повітря операційних до початку операції повинен містити не більше 500, а після неї — не більше 1000 мікробів в 1 м 3 . Staph, aureus не повинні виявлятися при дослідженні 250 л повітря. У передопераційних і перев’язувальних до початку роботи кількість мікробів в 1 м 3 не повинно перевищувати 750. У лікарняних палатах влітку число мікробів має бути менше 3500, а взимку — менше 5000 в 1 м 3 . Тут допускають наявність стафілококів в повітрі: влітку — 24, взимку-52 при дослідженні 250 л повітря.